| Per
il sequenziamento bisogna effettuare una elettroforesi ad alta risoluzione,
ed essere svolta sempre in condizioni denaturanti. Possiamo usare
l’elettroforesi su gel o l’elettroforesi capillare.
ElettroForesi Su Gel.
Si utilizza un gel di poliacrilammide, prodotto dalla
polimerizzazione dell’acrilammide e della bis-acrilammide
(19 : 1).
La percentuale di poliacrilammide nel gel varia dal 4 all’
8 percento. Questi gel consentono di separare frammenti che
differiscono l’uno dall’altro, anche di un solo nucleotide
(ed è questo lo scopo).
· acrilammide 4%: separo frammenti di maggior
peso molecolare, possiamo leggere la nostra sequenza da 500
fino a 1500 nucleotidi a partire dal primer.
· acrilammide 8%: separo frammenti con dimensioni
molecolare più piccole, potendo leggere a partire da 50 fino a 400
nucleotidi dal primer.
In pratica la stessa miscela di reazione può essere caricata
su due diversi gel, e potremo leggere da 50 nucleotidi fino
a 1500 dal primer. I frammenti di DNA che vogliamo
separare sono a singola elica, e vogliamo separarli in base
al loro peso molecolare, e non in base alle possibili conformazioni
assunte (shape). Questo significa che nel nostro gel
dobbiamo inserire una sostanza che faciliti la denaturazione
di DNA.
Il denaturante per antonomasia è l’urea, di solito in concentrazione
7 molare.
In più per facilitare la denaturazione e per mantenere costanti
le condizioni del gel si mantiene il gel attorno ai 50–60°C
durante la corsa. Poiché queste corse vengono compiute
ad alto voltaggio, si ha già di per se la formazione di calore durante
la corsa, si tratta quindi di distribuirlo uniformemente
(sistemi di termostatazione particolari).
Per quanto riguarda le dimensioni dei gel, si possono costruire
gel con lunghezza compresa fra 50 e 100 cm, con spessori sottilissimi,
da un millimetro a 20 micron. Si sfrutta la lunghezza per separare
maggiormente le singole bande, mentre l’esiguo spessore serve per
aumentare la risoluzione delle bande (molto nette), disperdere più
rapidamente il calore, e assicurarsi una miglior polimerizzazione
fra acrilammide e poliacrilammide (queste reazione
è inibita dall’ossigeno e tra le maglie di un gel sottile c’è minor
ossigeno), garantendo un gel più uniforme.
Poiché dobbiamo ridurre il gradiente termico che si viene
a formare, siamo facilitati nell’opera se il gel è più sottile.
Possiamo pure usare un voltaggio più elevato e quindi minor tempo.
Il gel in genere è tenuto in posizione verticale (minor spazio occupato).
Questo tipo di elettroforesi può essere utilizzato sia in caso di
marcature radioattive che in caso di marcature fluorescenti.
Il controllo della corsa è sempre tramite markers colorati che seguono
il fronte d’onda.
ElettroForesi Capillare
Usiamo microcapillare in silice fusa, con diametro interno compreso
fra 10 e 100 micron (sottilissimi), possono avere una lunghezza
tra i 30 e i 50 cm. Sono riempiti da una sostanza che funge da setaccio
molecolare (simile al gel). La matrice può essere poliacrilammide,
dimetilacrilammide o altri polimeri lineari come polietilenossido
o idrossietilcellulosa. Anche qui per aumentare la risoluzione
possiamo giocare su:
- la % di polimero utilizzato;
- la lunghezza della corsa;
- il voltaggio;
- la temperatura a cui avviene compiuta la corsa.
Questo tipo di elettroforesi può essere utilizzato solo nel caso
in cui si abbia una marcatura fluorescente: a livello del capillare
ad un certo punto ci sarà una fessura attraverso la quale passerà
una luce laser, in grado di eccitare i fluorocromi e indurre una
risposta captabile dai rilevatori.
Vantaggi:
Essendo il capillare più sottile rispetto al gel, avremo una
dissipazione più efficiente, quindi possiamo usare voltaggi più
alti. Il risultato finale è che il tempo necessario per la corsa
di riduce fino a 14 volte.
È stato pure osservata una riduzione del numero di compressioni
(anomalie dovute a strutture secondarie accidentali).
Il caricamento è sempre automatico: caricamento elettrocinetico:
il campione viene aspirato dalla provettina che lo contiene e portato
velocemente dentro la matrice. L’efficienza di caricamento permette
di utilizzare pure minor q.tà di campione.
Sono stati sviluppati sequenziatori automatici che possono far correre
in parallelo 16, 96, o 384 capillari. Naturalmente questo sistema
è stato ottimizzato in laboratori coinvolti in progetti genomici.
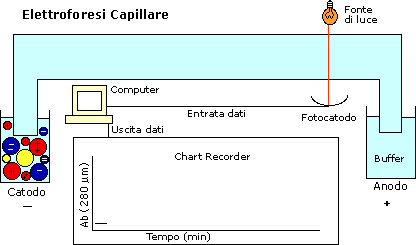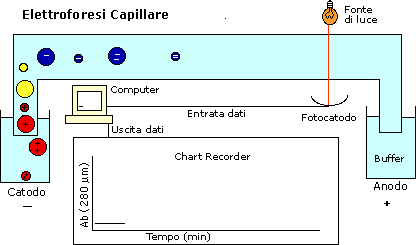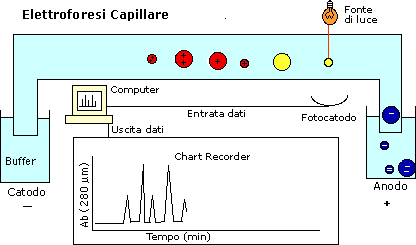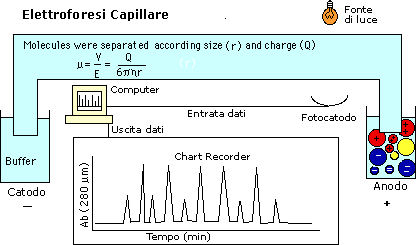
Differenze nel potere risolutivo fra elettroforesi
su gel e elettroforesi capillare.
Si dice in genere che l’E.C. ha risoluzione più alta rispetto all’E.G.,
ma se i guarda attentamente la letteratura si vede che la grande
differenza riguarda solo i tempi: con E.G. ecco una tabella riassuntiva.
| Elettroforesi |
Marcatura |
Lunghezza |
Spessore |
Voltaggio |
Risoluzione |
Tempo |
| su gel |
radioattiva |
100 cm |
200 – 600 μm |
30 V/cm |
500 nt |
7 ore |
| su gel |
fluorescente |
|
100 μm |
75 – 85 V/cm |
600 nt |
1 ora |
| capillare |
fluorescente |
30 cm |
100 μm |
150 V/cm |
700 nt |
1 ora |
Difficoltà durante il sequenziamento: stampi difficili.
Per stampi difficili si intendono sequenze GC-rich, AT-rich,
o palindromiche. Questa sequenza danno luogo a strutture secondarie
stabili, causando terminazione prematura della polimerizzazione
con conseguenti falsi stop. Ma a livello della corsa elettroforetica,
causano fenomeni di compressione: i frammenti migreranno sulla base
della loro configurazione, rallentando la corsa. Sono quindi da
considerarsi artefatti elettroforetici, evidenziabili dal fatto
che le bande (che differiscono da un solo nucleotide) non sono distanziate
uniformemente.
Per evitare la formazione di queste strutture che si fa?
Il modo più corretto è quello di risolvere il nostro stampo sia
su un filamento che sull’altro: in questo modo le compressioni si
svilupperanno su estremità opposte a seconda del filamento, e confrontanto
le due corse elettroforetiche si potrà risalire alla sequenza corretta.
Un altro dei metodi utilizzato è quello di compiere l’elettroforesi
ad una temperatura più elevata, oppure nel gel di sequenza, oltre
all’urea si può aggiungo una percentuale di formammide, aumentando
le caratteristiche denaturanti del gel. Oppure si possono utilizzare
dei deossinucleotidi analoghi della guanina che danno legami meno
stabili con la citosina.
|



