DA DEMOCRITO ALLA TEORIA ATOMICA DI DALTON
Molti secoli dopo l'intuizione di Democrito, fu dimostrata l'esistenza degli atomi.
A. L. Lavoisier, L. Proust e J. Dalton dimostrarono che la materia era formata da atomi.
J. L. Proust
Un altro chimico dell'epoca, che contribuì ad affermare l'esistenza degli atomi, fu Proust (1799). Questi constatò che gli elementi si combinavano per generare un composto sempre nello stesso rapporto.
Come abbiamo visto, nell'esempio precedente nella legge della conservazione della massa di Lavoisier: 2 grammi di rame (Cu) si combinano con 1 grammo di zolfo (S) per ottenere 3 grammi di solfuro di rame (CuS). Il rapporto di combinazione è di 2 a 1.
Nell'esempio successivo abbiamo visto che 1 grammo di idrogeno si combina con 8 grammi di ossigeno per ottenere 9 grammi di acqua. Il rapporto di combinazione in questo caso è di 1 a 8.
La curiosità di Proust fu quella di mantenere costante la quantità di rame facendo variare la quantite di zolfo e vedere quanto prodotto si formava. Successivamente mantenne costante la quantità di zolfo e fece variare la quantita di rame.
I risultati sperimentali furono i seguenti:

|
|
63.456 grammi di rame si combinano quantitativamente con 32.06 grammi di zolfo per dare 96,606 grammi di solfato di rame (CuS). |

|
|
126.912 grammi di rame si combinano con 32.06 grammi di zolfo per dare 96.606 grammi di solfato di rame (CuS) + 63.456 grammi di rame non combinato. |
|
|
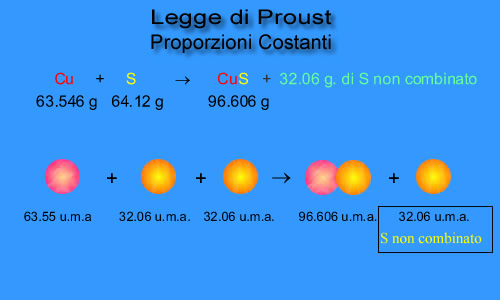
63.456 grammi di rame si combinano quantitativamente con 64.12 grammi di zolfo per dare 96.606 grammi di solfato di rame (CuS) + 32.06 grammi di zolfo non combinato. |
Tutto ciò fece comprendere a Proust che il rapporto di combinazione tra i due elementi rame (Cu) e zolfo (S) era sempre costante e quindi la materia è costituita da tante piccolissime particelle chiamati atomi.
Quindi, 1.98 grammi di rame si combinano sempre con 1 grammo di zolfo, questo perchè contengono lo stesso numero di atomi.
Se noi raddoppiamo la quantità di rame (3.96 grammi) raddoppieremo anche la quantità di atomi e affinchè la reazione sia quantitativa dobbiamo raddoppiare anche la quantità di zolfo (2 grammi) per avere lo stesso numero di atomi (3.96 grammi di rame si combinano quantitativamente con 2 grammi zolfo).
|
|
|
|