DA DEMOCRITO ALLA TEORIA ATOMICA DI DALTON
Molti secoli dopo l'intuizione di Democrito, fu dimostrata l'esistenza degli atomi. A. L. Lavoisier, L. Proust e J. Dalton ne dimostrarono l'esistenza.
J. Dalton
Dalton (1766-1844) si rese conto che alcuni elementi combinandosi tra di loro, potevano dare origine a due o più composti, ad esempio, idrogeno (H) e ossigeno (O) potevano dare origine a due composti diversi: acqua (H2O) e perossido d'idrogeno (H2O2).
Dalton tenendo conto della legge di Proust (Legge delle proporzioni costanti) e della legge di Lavoisier (Legge della conservazione della massa) impostò il seguente esperimento:
| gr. di idrogeno (H) | gr. di ossigeno (O) | gr. composto | Composto |
| 1 grammo | 8 grammi | 9 grammi di acqua | H2O |
| 1 grammo | 16 grammi | 17 grammi di perossido | H2O2 |
Dalton osservando i dati sperimentali si rese conto che le masse di ossigeno presenti nei due composti, acqua (H2O) e perossido d'idrogeno (H2O2) si trovavano nel seguente rapporto:
semplificando otterremo:
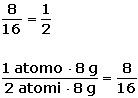
1 __ 2 Dove, si legge in questo caso, 1 a 2 e non un mezzo.
Uno (1) e due (2) stanno ad indicare il numero di atomi di ossigeno presenti nei due composti. Infatti nell'acqua (H2O) è presente un solo atomo di ossigeno, e nel perossido d'idrogeno (H2O2), sono presenti due atomi di ossigeno. Concludendo, Dalton disse:
Se due elementi danno origine a due o più composti (ad esempio H2O e H2O2) mantenendo costante la massa di un elemento (in questo caso la massa dell'idrogeno presente nei due composti ), notiamo che le masse del secondo elemento (in questo caso dell'ossigeno presente nei due composti), sono esprimibili con un rapporto di numeri interi e piccoli.
Dalton da queste tre leggi (legge della conservazione della massa, legge delle proporzioni costanti, legge delle proporzioni multiple) formulò la seguente teoria. La materia che ci circonda sia allo stato solido, liquido o gassoso è formata da tante piccolissime particelle chiamati atomi. La sua teoria prende il nome di Teoria atomica di Dalton.
La teoria atomica di Dalton si basa su questi concetti fondamentali:
| MATERIA | |||||
| ELEMENTI | COMPOSTI | ||||
| ATOMI UGUALI H2, O2, N2, ... |
ATOMI DIVERSI H2O, CO2, N2O5, ... |
||||
|
|
|
|