DA THOMSON AL MODELLO ATOMICO DI RUTHERFORD
Thomson
L'atomo con Rutherford assume un nuovo volto. Ma, prima di passare al modello atomico di Rutherford vi parlerò del modello atomico di Thomson.Dalton vede l'atomo, come viene descritto nella sua teoria atomica, come una particella intera e indivisibile.

E già noto che una bacchetta se strofinata si elettrizzava, ed era in grado di attrarre a se pezzettini carta.

Questo fenomeno particolare della materia incuriosì alcuni
scienziati. La materia era in grado di elettrizzarsi. Se una bacchetta di ambra
di vetro o altro materiale non conduttore veniva strofinato vi era una separazione di
cariche: positive e
negative.
L'atomo considerato una particella indivisibile e
neutro era in realtà formato da altre piccolissime particelle
positive e negative in ugual numero,
non restava che scoprile.
Verso la fine del 1800 furono scoperti gli
elettroni.
Per scoprire gli elettroni
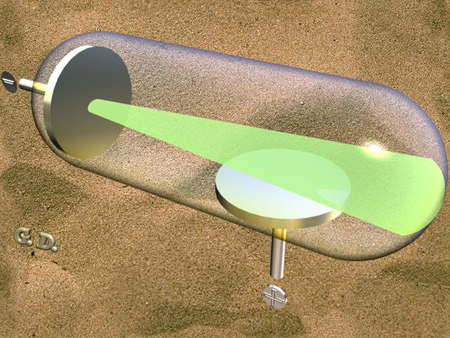
fu utilizzato da Thomson un tubo di vetro (una lampada di
Crookes). All'interno di questa lampada fu praticato il vuoto.
( fig.1 ).
Thomson collegò i due ellettrodi (catodo
, elettrodo negativo, e
l'anodo, elettrodo
positivo) a un generatore di corrente continua, stabilendo
una differenza di potenziale pari a 1000 v. E, notò che dal
catodo partiva un fascio di
luce verde fluorescente e in moto rettilineo si dirigeva verso l'
anodo.
Thomson, per costatare la natura di tale
raggio (raggi catodici
) all'interno del tubo, inzialmente mise un mulinello e notò che il fascio di luce
era di natura particellare, poi un campo elettrico (fig. 2
), e notò che questo (di carica negativa) si dirigeva
verso la lamina positiva. Thomson concluse:

Se nell'atomo erano presenti le cariche
negative, gli elettroni,
dovevono esistere anche le cariche positive, i
protoni, affichÊ l'atomo risultasse
neutro. La scoperta dei protoni
non tardò molto, venne utilizzata una lampada di Crookes modificata.
All'interno del tubo venne messo idrogeno a bassa pressione, e venne
utilizzato un catodo forato. La forte differenza di
potenziale ionizzò l'atomo d'idrogeno: in una carica
positiva, protone e in una carica
negativa, elettrone.
| H· | + | energia
|
---> |
H + | + | e - |
| atomo neutro | Protone | elettrone |

Thomson dopo la scoperta dell'elettrone e del
protone, immaginò l'atomo come una sfera omogenea e
compatta con carica positiva e all'interno della quale vi erano
gli elettroni con carica negativa. questo modello
atomico prende il nome di modello a panettone, l'uva passa sono gli
elettroni e la pasta è la carica positiva
.
Nella figura sottostante viene rappresentato il modello atomico di Thomson.

|
|