ELETTRONEGATIVITÀ
L´elettronegatività è la capacità di un atomo di
attrarre a se gli elettroni di legame.
Gli elementi più elettronegativi appartengono al VII
gruppo sottogruppo A (VIIA) e il fluoro (F) è l´elemento più
elettronegativo, la sua elettronegatività secondo Pauling è pari a 4.
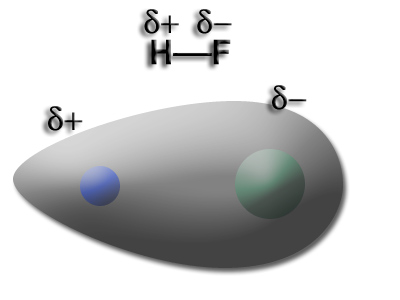
Per compredere l´elettronegatività è necessario compredere il concetto di affinità elettronica.
L´ affinità elettronica è l´energia che si sviluppa quando un atomo acquista elettroni, assomigliando al gas nobile che lo segue. Gli elettroni che un atomo acquista dipende dalla sua configurazione elettronica. Come esempio prenderemo in considerazione l´atomo di fluoro (F). Il fluoro ha 9 protoni e 9 elettroni la sua configurazione elettronica è:
Il Fluoro per completare il suo ultimo livello energetico acquista un solo
elettrone e assume in questo modo una configurazione elettronica stabile simile al gas nobile neon
(Ne).
| F | ≡ | 1s2 2s2 2p5 |
| F - | ≡ | 1s2 2s2 2p6 |
| Ne | ≡ | 1s2 2s2 2p6 |
L´atomo di ossigeno (O) a differenza dell´
atomo di fluoro per completare il suo ultimo livello energetico occorrono 2
elettroni. La Configurazione elettronica dell´ossigeno è:
Il fluoro ha una tendenza maggiore rispetto all´ossigeno ad
acquistare elettroni, quindi, l´energia (affinità elettronica)
che sviluppa quando acquista elettroni è maggiore rispetto all´
ossigeno.
Gli elementi non metallici hanno una affinità elettronica più
alta rispetto agli elementi metallici, questo perché hanno il loro ultimo livello è quasi completo.
Nella chimica l´elettronegatività, a differenza dell´afinità
elettronica, assume un ruolo fondamentale in particolar modo nei legami chimici. Dalla differenza di
elettronegatività è possibile stabilire il tipo di legame che si viene ad estaurare tra due
elementi (ionico, covalente puro o polare).
Pauling riuscì a determinare l´elettronegatività degli
elementi chimici utilizzando la seguente formula empirica:
dove:
[Δ = E(sperimentale) - E(calcolato)].
Come esempio vediamo di calcolare l´elettronegatività del fluoro sapendo che:
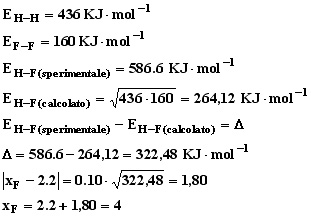
Paulig utilizzando la formula empirica riportata sopra
(|XA - 2.2| = 0.10·√Δ), riuscì a determinare
l´elettronegatività di tutti gli elementi e notò che l´elettronegatività
aumentava lungo un periodo e diminuiva lungo un gruppo vedi tabella:
| Aumenta ---------→ | ||||||||||||||||||
|
D i m i n u i s c e |
| | | | ↓ |
|||||||||||||||||
|
H 2.2 |
||||||||||||||||||
| Li 1.0 |
Be 1.5 |
B 2.5 |
C 2.5 |
N 3.0 |
O 3.5 |
F 4.0 |
||||||||||||
| Na 0.9 |
Mg 1.2 |
Al 1.5 |
Si 1.8 |
P 2.1 |
S 2.5 |
Cl 3.0 |
||||||||||||
| K 0.8 |
Ca 1.0 |
Sc 1.3 |
Ti 1.5 |
V 1.6 |
Cr 1.6 |
Mn 1.5 |
Fe 1.8 |
Co 1.8 |
Ni 1.8 |
Cu 1.8 |
Zn 1.6 |
Ga 1.6 |
Ge 1.8 |
As 2.0 |
Se 2.4 |
Br 2.8 |
||
| Rb 0.8 |
Sr 1.0 |
Y 1.2 |
Zr 1.4 |
Nb 1.6 |
Mo 1.8 |
Tc 1.5 |
Ru 2.2 |
Rh 2.2 |
Pd 2.2 |
Ag 2.4 |
Cd 1.7 |
In 1.7 |
Sn 1.8 |
Sb 1.9 |
Te 2.1 |
I 2.5 |
||
| Cs 0.7 |
Ba 0.9 |
La 1.1 |
Hf 1.3 |
Ta 1.5 |
W 1.7 |
Re 1.9 |
Os 2.2 |
Ir 2.2 |
Pt 2.2 |
Au 2.4 |
Hg 1.9 |
Tl 1.8 |
Pb 1.8 |
Bi 1.9 |
Po 2.0 |
At 2.2 |
||
| Fr 0.7 |
Ra 0.9 |
Ac 1.1 |
||||||||||||||||