VITALISMO E MECCANICISMO
NELLA STORIA DELLA BIOLOGIA
I primi passi di una nuova scienza: la Chimica
Le definizioni
La circolazione
del sangue
Gli esperimenti di Priestley sui gas
e la scoperta dell’ossigeno
Nel XVIII secolo lo studio dei gas, iniziato da van Helmont, procedeva con
particolare rapidità e diventava inevitabile che si esplorassero i rapporti
tra i vari gas e la vita.
Il primo esploratore in questo nuovo settore fu il botanico e chimico
inglese Hales, il quale nel 1727 pubblicò un libro in cui riportava le sue
misure della velocità di crescita delle piante e della pressione della linfa
(viene per questo considerato il fondatore della
fitofisiologia). Fece anche diversi esperimenti con i gas e fu il
primo a rendersi conto che uno di questi, l’anidride carbonica, contribuiva
in qualche modo all’alimentazione delle piante.
Il passo successivo fu compiuto mezzo secolo dopo da Joseph Priestley
(1733-1804). Egli scoprì nel 1774 il gas che oggi chiamiamo
ossigeno: constatò che questo gas era
piacevole a respirarsi e che i topi diventavano particolarmente vivaci
quando venivano posti in una campana di vetro contenente questo gas; si rese
anche conto che le piante aumentavano la quantità di ossigeno presente
nell’aria. Il medico olandese Ingenhousz dimostrò inoltre che il processo in
base al quale le piante consumano anidride carbonica e producono ossigeno,
ovvero la fotosintesi clorofilliana,
si svolgeva soltanto in presenza della luce.
Gli esperimenti di Lavoiser
Colui che viene considerato il fondatore della chimica moderna è Antoine
Laurent Lavoisier (1743-94), il quale sottolineò l’importanza delle misure
accurate negli esperimenti e se ne servì per elaborare una
teoria della combustione che è valida
tuttora.
Secondo questa teoria, la combustione è il risultato
di un’unione chimica tra il materiale che brucia e l’ossigeno dell’aria.
Lavoisier dimostrò inoltre che l’aria contiene, oltre l’ossigeno, anche
l’azoto (dal greco: a-zoon, ovvero senza vita).
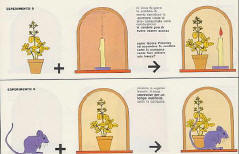
La “nuova chimica” di Lavoisier si poteva applicare anche agli esseri
viventi, perché in un certo senso ciò che valeva per una candela era valido
anche per un topo. Quando si fa bruciare una candela in una campana chiusa,
si consuma ossigeno e si produce anidride carbonica (questa si forma dalla
combinazione del carbonio contenuto nella sostanza che forma la candela con
l’ossigeno). Una volta consumato tutto l’ossigeno dell’aria racchiusa nella
campana, la candela si spegne. Lo stesso accade per la vita animale: un topo
messo sotto una campana di vetro consuma ossigeno e forma anidride carbonica
(carbonio dei tessuti + ossigeno).
Da un punto di vista generale, le piante consumano
anidride carbonica e producono ossigeno; mentre gli animali consumano
ossigeno e producono anidride carbonica. Nel complesso, quindi, le piante e
gli animali contribuiscono a conservare l’equilibrio chimico, cosicché, a
lungo andare, nell’atmosfera il contenuto di ossigeno (21%) e di anidride
carbonica (0,03%) rimane costante.
Dal momento che la candela e l’animale generano anidride carbonica e
consumano ossigeno, a Lavoisier sembrò ragionevole supporre che la
respirazione fosse una forma di combustione e che al consumo di una data
quantità di ossigeno corrispondesse la produzione di una data quantità di
calore, sia nel caso della candela che in quello del topo.
Si trattava di un grande successo della
teoria meccanicista, poiché se ne poteva dedurre che sia nella materia
vivente che in quella non vivente si svolgesse il medesimo processo chimico.