"Il legame di legante"
Un comune evento in un sistema biologico è la formazione di un legame non-covalente di uno o più piccole molecole (leganti)su una molecola come una proteina. Infatti l'attività biologica di una proteina, per esempio enzimi, dipende dalla presenza di alcuni legantiì. L'analisi degli equilibri dei legami richiede una semplice equazione algebrica.
Cominciamo scrivendo l'equazione per la dissociazione del legante(L) della proteina (P)
![]()
e scriviamo le reazione della costante di dissociazione
.![]()
Un parametro utile per tracciare un grafico è questo q che rappresenta
![]()
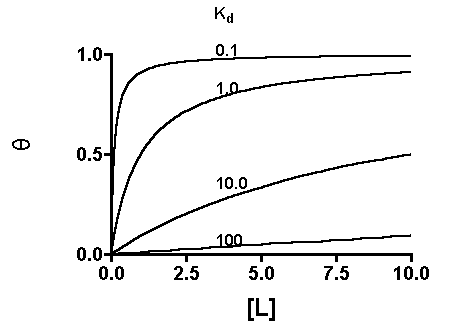
cioè la frazione di Proteina legata al legante. Si ottiene un grafico del tipo (Legante e Proteina)
Combinando l'equazione 2 e 3 si ottiene
![]()
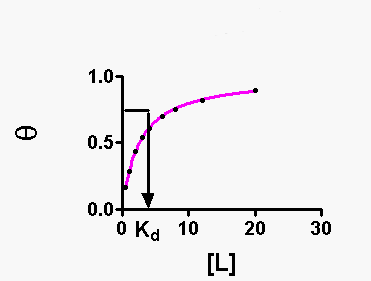
che è l'equazione dell'iperbole. La concentrazione dei leganti (L), per cui q = 0.5 è uguale alla Kd.
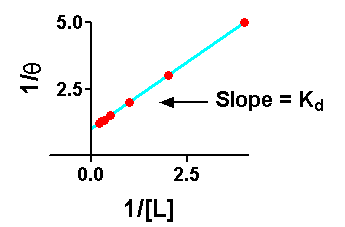
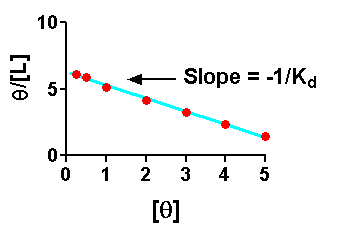
Di solito, si usa una trasformazione lineare dell'equazione di legame, quali
| |
|
|
Diagrammando queste equazioni si ottengono dei grafici lineari che portano ad ottenere un Kd più accurato.
 |
 |
Una volta determinata Kd, l'energia libera di dissociazione può
essere determinata da DGo=-RTlnKd.
L'energia libera di associazione o energia libera di legame è
-DGo
di dissociazione, poichè Ka = 1/Kd.
ESEMPIO
Per il legame di un certo ligante ad una proteina su di una proteina a 25° C e pH=7.0, Kd = 1x10-7 M. Qual è l'energia libera di associazione del ligante con la proteina?
- Per la reazione di dissociazione DGo' = -RTlnKd
- DGo' = -(8.314)(298)(-16.1) = + 39.9 kJ/mol a dissociazione non è favorita
- Per la reazione di associazione DGo' = -RTlnKa = -RTln(1/Kd).
- DGo' = -(8.314)(298)(16.1) = - 39.9 kJ/mol -l'associazione è favorita
LA TERMODINAMICA E I VIRUS HIV
Durante la replicazione, il virus dell'AIDS produce una larga catena polipeptidica, che viene spezzettata in piccole proteine richieste per la costituzione del virus. Lo spezzettamento della proteina suddetta è attuata da uno specifico enzima chiamato HIV-proteasi. In assenza dell'HIV-proteasi, il virus non può maturare ed infettare le cellule
Perciò l'HIV-proteasi è stato oggetto di un intenso studio per cercare di scoprire inibitori che possono prevenire la replicazione del virus. Una grande varietà di composti sono stati svillupati come mostrato sotto.
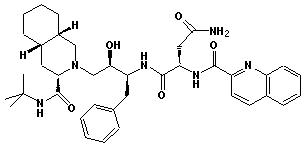 |
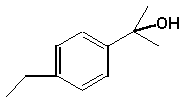 |
Questi composti hanno un 'alta affinità con l'HIV-proteasi Kd = 5-15 x 10-8 M (hiv).
IL VIRUS CONTRATTACCA
La presenza di un inibitore esercita una forte pressione sul virus che
svilupperà una forma inibitor-resistente della proteasi. Apparentemente
il virus sembra più preoccupato di avere una proteina con una bassa
affinità per l'inibitore piuttosto che una proteina con un'alta attività
enzimatica. I legami degli inibitori con un tipo di HIV-proteasi violento
producono mutazioni resistenti
| Compound |
Kd(nM) |
|||
|
|
Specie selvatica |
V82F |
I84V |
V82F/I84V |
| |
|
|
|
|
| |
|
|
|
|
| |
|
|
|
|
| |
|
|
|
|
| |
|
|
|
|
Quanto deve cambiare la Kd per alterare significativamente la quantità di inibitore legato?