"La Bioenergetica"
La bioenergetica è lo studio quantitativo di come i sistemi biologici producono ed usano l'energia. La bioenergetica è un branca della termodinamica ed è essenziale per:
- Comprendere come si produce energia a partire dai processi metabolici
- Comprendere la struttura delle macromolecole
- Comprendere come avviene il trasporto nelle membrane
In breve, per la comprensione di tutti i processi fondamentali
che definiscono la biochimica. Noi siamo particolarmente interessati agli
usi bioenergetici per descrivere le condizione in cui i processi avvengono
spontaneamente.
Sebbene noi possiamo usare la bioenergetica per determinare se un processo
accadrà spontaneamente, questa non ci dà informazioni
sulla velocità delle reazioni.
ENERGIA LIBERA
La funzione termodinamica che è molto usata nella biochimica è l'Energia Libera di GIBBS G=H-T*S che mette insieme:
- entalpia H, una misura dell'energia del sistema a pressione costante
- entropia S, una misura del grado di disordine
Per ogni processo:
- se DH è negativo allora il calore è ceduto all'esterno questo è uno scambio entalpico favorito
- se DS è positivo allora il grado di disordine aumenta-questo è uno scambio entropico favorito
Per ogni processo, la variazione di energia libera è data da DG=DH-T*DS
- Se il DG <0 il processo è spontaneo.
- Se il DG=0 il processo è all'equilibrio
- Se il DG>0 il processo non è spontaneo ( infatti il processo inverso è spontaneo )
- Il valore e il segno del DG dipendono dall'azione reciproca di entropia ed entalpia. Il solo fato che il DH è negativo non vuol dire affatto che il DG sarà negativo e appunto se il DS è positivo non significa affatto che il DG sarà negativo
Consideriamo la fusione del ghiaccio e i valori di DG, DH, DS al variare della temperatura. Per la fusione del ghiaccio il DH è positivo (sfavorita) perché si devono rompere i legami a idrogeno . Il DS è positivo (favorita) perché le molecole dell'acqua nel liquido sono più disordinate di quelle del ghiaccio. Si veda l'esempio numerico descritto qui di seguito
- temperatura +10°C,| DH= +6.4 kJ/mol, -TDS = -6.6 kJ/mol; DG= -0.2 kJ/mol;
di conseguenza il ghiaccio si scioglie - temperatura 0°C, |DH= +6. kJ/mol, -TDS = -6.0 kJ/mol; DG= -0 kJ/mol;
di conseguenza il ghiaccio coesiste con l'acqua liquida - temperatura -10°C, |DH= +5,6 kJ/mol, -TDS = -5,4kJ/mol; DG= +0.2 kJ/mol;
di conseguenza il ghiaccio si forma
Il valore e il segno del DG dipendono dall'azione reciproca di entropia ed entalpia. Il solo fato che il DH è negativo non vuol dire affatto che il DG sarà negativo e appunto se il DS è positivo non significa affatto che il DG sarà negativo. Nelle tabelle sotto ci sono esempi che illustrano come DH e DS interagiscono per dare un DG favorevole
- C6H12O6 ® 2C2H5OH
+ 2CO2| DH= -82 kJ/mol, -TDS = -136kJ/mol; DG=-218 kJ/mol;
di conseguenzaDH favorisce; DS favorisce - C2H5OH + 3O2 ® 2CO2 + 3H2O|DH= -1367 kJ/mol, -TDS =+41 kJ/mol; DG= -1326kJ/mol;
di conseguenza DH favorisce; DS si oppone - N2O5 ® 2NO2 + 1/2O2, |DH= +110 kJ/mol, -TDS =-140kJ/mol; DG=-30 kJ/mol;
di conseguenza il ghiaccio si forma
Anche la temperatura gioca un ruolo importante per la determinazione del segno del DG (DG=DH-TDS). In generale si può dire:
| DH |
DS |
Bassa Temperatura |
Alta Temperatura |
| + |
+ |
DG +; non favorita |
DG -; favorita |
| + |
- |
DG +; no favorita |
DG +; non favorita |
| - |
+ |
DG -; favorita |
DG -; favorita |
| - |
- |
DG -; favorita |
DG +; non favorita |
ENERGIA LIBERA E REAZIONI CHIMICHE
Se l'Energia Libera fosse tutta qui sarebbe ben poco utile. possiamo usare un altro modo per definire l'energia libera che è particolarmente utile per lo studio delle reazioni chimiche.
-
Per un composto A in soluzione si definisce il Potenziale Chimico
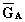 come
come 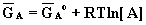 dove
dove 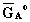 rappresenta l'energia
libera di A nel suo stato fondamentale (standard).Una simile equazione
può essere scritta per ogni componente della soluzione.
rappresenta l'energia
libera di A nel suo stato fondamentale (standard).Una simile equazione
può essere scritta per ogni componente della soluzione. -
Per la reazione
 l'energia libera completa è data da
l'energia libera completa è data da 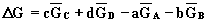
-
Dopo aver applicato l'equazione per il potenziale chimico di ogni componente, otterremo:
-
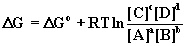
-
DG° è l' energia della reazione quando ogni componente è nel suo stato standard
-
Alternativamente determinare DG°notando che all'equilibrio DG°=RTln Keq
COSTANTI DI EQUILIBRIO E VARAIZIONE DI ENERGIA LIBERA
Una delle importanti reazioni nelle biochimica è l'idrolisi dell' ATP
ATP-4 + H2O
Û
ADP-3 + HPO4-2 + H+
Come possiamo calcolare l'energia libera di questa reazione ? L'energia
libera di questa reazione è data da:
![]()
In biochimica, si fanno due premesse quando si affrontano questi problemi:
- La concentrazione dell'acqua non cambia durante la reazione
- Il pH è 7 e non cambia durante la reazione
Sotto queste condizioni [H2O] e la [H+] sono incluse nel DG a dare un nuovo standard di energia libera:DG0'
Usando queste premesse e per semplificare scriveremo:
- ADP invece di ADP-3
- ATP invece di ATP -2
- Pi invece di HPO4-
L'equazione diventa
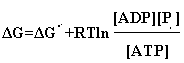
ALCUNE CONSIDERAZIONI PRATICHE
Come noi otteniamo i valori di DH, DG, e DS? Una via è studiare la temperatura dipendente dalla costante di equilibrio della reazione.
Usiamo l'equazione di van't hoff
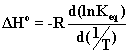
Quindi mettendo in grafico con RlnKeq su1/T si otterrebbe una linea con pendenza uguale a -DH. Questi dati mostrano la dipendenza dalla temperatura del processo di denaturazione di una proteina, che può essere descritto con una conversione da uno stato naturale N allo stato denaturato D.
![]()
Da questo grafico si ha una retta che ha un pendenza -586=-DH,
quindi
-
DH=586KJ/mol.
-
A 54,5°, la Keq è uguale a 0,27.
-
quindi DG=3,56KJ/mol sfavorita a questa temperatura
-
Ricordando che DG=DH-TDS, DSo = (DHo - DGo)/T = 1,620 J/mol*K.
Quindi DH sfavorisce il processo mentre DS lo favorisce.
REAZIONI ACCOPPIATE
La maggior parte delle reazioni che caratterizzano la nostra vita hanno bisogno di energia quindi sono endoergoniche.
-
Una reazione endoergonica quella sfavorita con DG positivo. Una reazione esoergonica è quella favorita con un DG negativo
-
Comunque una reazione endoergonica può essere condotta in una direzione desiderata se accoppiata ad una reazione esoergonica
Per esempio la fosforilazione del glucosio produce 6-fosfato:essa è una reazione molto importante per le cellule
- Glucosio + Pi Û glucosio-6-fosfato + H2O| DGo' = + 14 kJ/mol, reazione sfavorita;
- ATP + H2O Û ---ADP + Pi-------------------- |DG°' = - 31 kJ/mol, reazione favorita;
- Glucosio +ATPÛ glucosio-6-fosfato------|DG°totale -17 kJ/mole reazione complessiva spontanea
