"Meccanismi catalitici"
 La
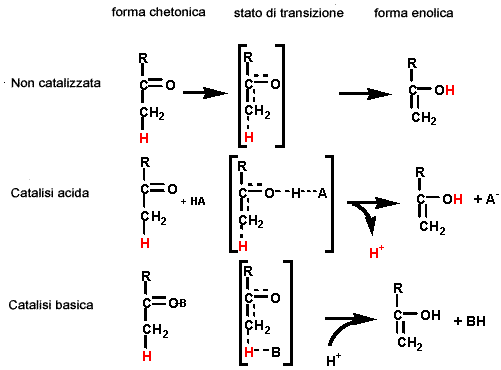
Catalisi acido-base generale è un meccanismo tipico nelle
reazioni enzimatiche, come nelle idrolisi dei legami esterei, peptidici,
dei gruppi fosfato...Coinvolge il passaggio di un protone dal catalizzatore.
La
Catalisi acido-base generale è un meccanismo tipico nelle
reazioni enzimatiche, come nelle idrolisi dei legami esterei, peptidici,
dei gruppi fosfato...Coinvolge il passaggio di un protone dal catalizzatore.
Sono coinvolte in genere le catene laterali dell'asparagina, glucina, istidina,
cisteina, tirosina e lisina
La catalisi covalente genera un incremento della velocità di reazione attraverso la formazione di legame covalente substrato catalizzatore. Partecipano a quest'altro meccanismo comune dell'enzimatica le catene laterali della Istidina, cisteina, asparagina, lisina e serina. Anche i coenzimi tiammina pirofosfato e pirodossale fosfato funzionano essenzialmente mediante una catalisi covalente.
Un altro meccanismo molto usato è la catalisi da Ione metallico. Legano i substrati con un'orientazione appropriata, mediano nelle reazioni redox, stabilizzano o mascherano cariche negative. I metalloenzimi contengono ioni Fe+2, Fe+3, Cu+2, Zn+2, Mn+2 legati strettamente, mentre gli enzimi metalloattivati invece contengono ioni Na+, K+, Mg+2, Ca+2 legati in modo debole.
La catalisi elettrostatica si riferissce al fatto che allorchè un substrato si lega all'enzima viene usualmente allontanata l'acqua dal sito attivo causando un abbassamento della costante dielettrica che a sua volta mette in risalto le interazioni tra cariche nel sito attivo.
Gli effetti di prossimità ed orientamento sono anche importanti nelle reazioni enzimatiche. Diverse catene laterali degli amminoacidi possono venire a trovarsi molto vicini al sito attivo a causa della conformazione spaziale dell'enzima e il legarsi del substrato nel sito attivo può orientare il substrato stesso in modo opportuno rispetto a queste catene laterali.
Legame preferenziale con lo stato di tranzione è probabilmente il più importante dei meccanismi. Avviene perchè l'enzima lega lo stato di transizone in modo più forte di quanto leghi il substrato o il prodotto, abbassando in questo modo il DGo‡ . Le interazioni deboli tra enzima e substrato vengosno così ottimizzate nello stato di tranzione. Come funziona questo meccanismo?

Si considerino queste analogie meccaniche. La reazione è quella a fianco.
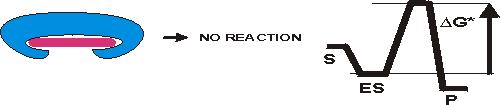 Se il sito attivo dell'enzima fosse complementare al substrato, allora DGo‡
ne risulterebbe aumentato e la reazione non verrebbe accellerata dall'enzima.
Se il sito attivo dell'enzima fosse complementare al substrato, allora DGo‡
ne risulterebbe aumentato e la reazione non verrebbe accellerata dall'enzima.
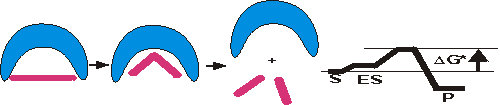 Se
il sito attivo è invece complementare allo stato di tranzione allora
DGo‡ verrebbe abbassato e la
reazione favorita.
Se
il sito attivo è invece complementare allo stato di tranzione allora
DGo‡ verrebbe abbassato e la
reazione favorita.
DG per la formazione dello stato di tranzione è in parte pagato dall'energetica delle interazioni deboli tra enzima e stato di transizone. Di quanta energia di legame c'è bisogno per spiegare il grande incremento delle velocità causate dagli enzimi? Per un'accelerazione di 106 volte DDGo± = 34.3 kJ/mol. Questo è pari alla formazione di due legami ad Idrogeno in più tra enzima e stato di tranzione a confronto dell'interazione tra enzima e substrato.

Stabilizzazione dello stato di transizone per mezzo degli enzimi
 Il
miglior inibitore è l'analogo dello stato di tranzione planare, il
2 pirrolo carbossilato, mentre l'analogo del substrato è un cattivo
inibitore.
Il
miglior inibitore è l'analogo dello stato di tranzione planare, il
2 pirrolo carbossilato, mentre l'analogo del substrato è un cattivo
inibitore.
 Gli anticorpi contro l'analogo dello stato di tranzione sono enzimaticamente
attivi, mentre quelli contro il substrato non hanno alcuna attività
Gli anticorpi contro l'analogo dello stato di tranzione sono enzimaticamente
attivi, mentre quelli contro il substrato non hanno alcuna attività
Questi anticorpi hanno un sito che lega e stabilizza lo stato di tranzione catalizzando così la reazione.
