"La regolazione degli enzimi"
L'attività enzimatica può essere regolata attraverso vari metodi:
- regolando la quantità di enzima durante i processi trascrizionali
- mediante la quantità di substrato
- controllo dell'attività, vale a dire, regolazione allosterica, inibitori, modificazioni covalenti.
Regolazione allosterica
Sono enzimi con più subunità, come l'emoglobina, ed osservano una cinetica differente dalla Michaelis Menten. Si può verificare il caso della Omosteria con attivazione e legame cooperativo del substrato.
Eteroallosteria, mediante la regolazione con molecole effettori, e può essere negativa e positiva. Gli effettori allosterici si legano ad un sito differente da quello catalitico. Le subunità dell'enzima si possono trovare in due stati, detti R e T. Possono attivare favorendo lo stato R o inibire favorendo lo stato T.

Curve cinetiche di enzimi di Michaelis Menten ed enzimi allosterici
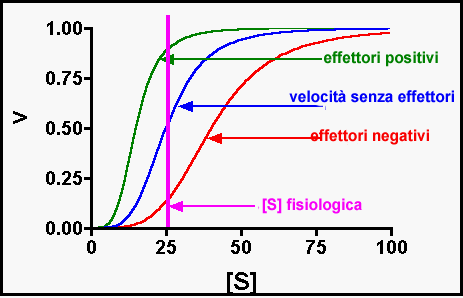
Curve cinetiche di enzimi allosterici in pesenza di effettori positivi e negativi
Altri modi di modulare gli enzimi sono i seguenti
 La modificazione reversibile covalente è largamente usata
per regolare l'attività enzimatica. Un esempio classico è
la fosforilazione della serina.
La modificazione reversibile covalente è largamente usata
per regolare l'attività enzimatica. Un esempio classico è
la fosforilazione della serina.
La modificazione irreversibile covalente si ha con enzimi che sono sintetizzati come precursori (zimogeno). L'attivazione dello zimogeno coinvolge la rimozione proteolitica di un amminoacido da una estremità amminica della proteina.
Inibizione enzimatica
L'uso di inibitori spesso fornise importanti informazioni su un meccanismo enzimatico. Molti farmaci sono degli inibitori come la pennicillina che inibisce la sintesi delle pareti cellulari nei batteri.
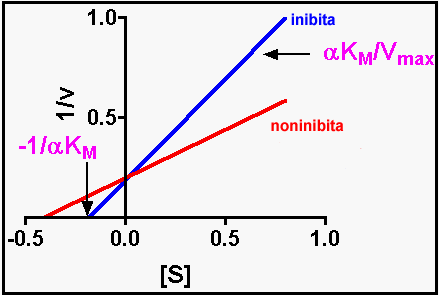
Un inibitore competitivo compete con il substrato nel legarsi al sito attivo. A sinistra sono mostrati gli equilibri a cui partecipa l'inibitore e l'equazione dei doppi reciproci con la presenza dell'inibitore. La Ki rappresenta la K dell'inibitore. A destra la retta dei doppi reciproci con un inibitore competitivo. Si noti come la Vmax sia la stessa in quanto l'inibizione competitiva viene rimossa ad alte [S] a causa della legge di azione di massa.

Un inibitore non competitivo si lega ad un sito diverso da quello del substrato ed inibisce la formazione del prodotto. In questo caso l'inibitore non impedisce al substrato di entrare sul sito attivo ma causa una modificazione del sito catalitico tale da rendere la catalisi impossibile. Di conseguenza la Km può anche rimanere la stessa ma la Vmax cambierà in quanto ci sono meno siti attivi liberi dall'inibitore.


Inibizione covalente: L'inibizione irreversibile o covalente coinvolge delle modificazione chimiche della proteina.

Differenze tra inibitori allosterici e inibitori noncompetitivi
Un inibitore si lega ad un enzima oligomerico in un sito differente dal sito attivo e stabilizza lo stato T. Poichè è un enzima allosterico il grafico della velocità contro [S] sarà ancora una sigmoidale e il grafico di Lineweaver Burk non sarà lineare.

A concentrazioni elevate di S l'inibizione sarà vinta poichè il legarsi del substrato converte l'enzima dallo stato T allo stato R. Si ricordi che si ha a che fare con la cooperatività positiva per cui una volta legato il substrato tutto il compless oè convertito a R. L'inibitore rende soltanto più difficile l'emtrata del substrato.

Un inibitore non competitivo si lega all'enzima in un sito differente da quello attivo e trasforma l'enzima in una forma inattiva. Poichè non è un enzima allosterico, si avrà la linearita dell'equazione di Lineweaver Burk dei doppi reciproci. Ad alti valori di S l'inibizione non sarà vinta poichè S non compensa l'effetto dell'inibitore che non fa altro che impedire all'enzima di partecipare alla reazione abbassando così la concentrazione dell'enzima libero.Vmax sarà abbassata perchè essa dipende da quanto enzima è presente mentre Km non sarà toccato perchè l'enzima libero mantiene la sua attività.
