"La cinetica di Michaelis Menten"
Il meccanismo enzimatico più semplice è costituito dei seguenti due stadi.
![]()
e la velocità di reazione è
![]()
Per poter derivare un'equazione utile che descriva questa reazione si fa l'assuzione che la reazione proceda attraverso uno stato stazionario per cui durante quasi tutta la reazione [ES] è piccola e non cambi, d[ES]/dt=0 .
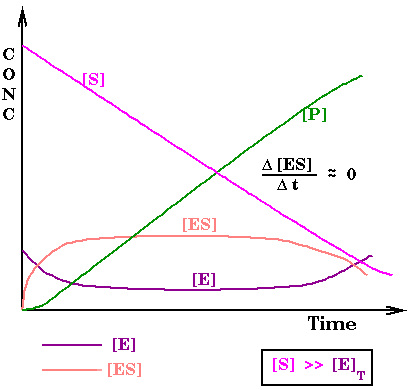
Con queste assunzioni si ricava l'equazione di Michaelis Menten.
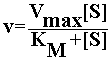
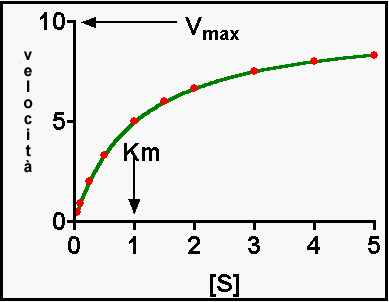
Grafico di Michaelis Menten
L'equazione di Michalis Menten è un'eiperbole equilatera e l'enzima viene caratterizzato da due costanti
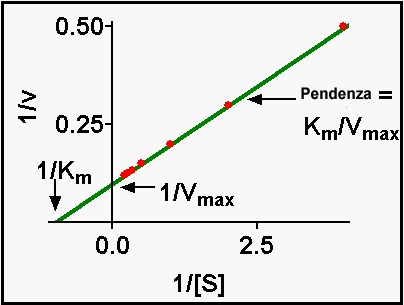
Km, cioè la concentrazione del substrato per cui v è metà della Vmax. Vmax, la velocità massimale della reazione che si ha quando [S]>>Km. Per la determinazione dei valori di Km e Vmax ci sono vari metodi di trasformazione. Uno dei più famosi è il grafico dei doppi reciproci o di Lineweaver Burk, per cui
![]()
Numero di Turnover
Il numero di turnover di un enzima, kcat, è la velocità massimale per molecola di enzima per unità di prodotto.
![]()
L'efficienza enzimatica
Rielaboando l'equazione della velocità si ha
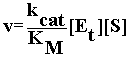
Quando [S] << KM, allora kcat/KM è una costante di velocità del secondo ordine ed è una misura dell'efficienza dell'enzima a basse [S]. Quando kcat/KM è 108-109 la reazaione è controllata dalla diffusione.
| |
|
|
|
|
| Catalasi |
H2O2 |
|
|
|
| Anidrasi Carbonica |
CO2 |
|
|
|
| Acetylcholine esterase |
Aceticolina |
|
|
|
| Fumarasi |
Fumarato |
|
|
|
Per substrati differenti kcat/KM è anche il miglior modo per determinare la specificità di un enzima.
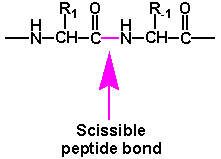
Nell'idrolisi di un legame peptidico per mezzo della chimotripsina è critica la natura della catena laterale R1 come si evince dalla seguente tabella, dove si nota che il migliore è la fenilalanina
| R1 |
kcat/ KM (M-1sec-1) |
| Gly |
1.3x10-1 |
| Val |
3.6x102 |
| Leu |
3.0x103 |
| Phe |
1.0x105 |