"La cinetica enzimatica"
Introduzione
Un catalizzatore è una sostanza che incrementa la
velocità di una reazione chimica. Gli enzimi sono dei catalizzatori
biologici di struttura a maggioranza proteica. Si denomina Substrato la
molecola su cui agisce il catalizzatore.
Benchè il catalizzatore prende parte alla reazione, rimane inalterato
alla fine del processo di reazione. Un catalizzatore aumenta la velocità
a cui una reazione raggiunge l'equilibrio ma non ne altera nè
Keq nè DGo' della
reazione. Un processo termodinamicamente favorito NON è reso più
favorito dalla presenza di un catalizzatore alla stessa maniera in cui
un processo sfavorito nonè reso favorito dalla presenza del catalizzatore.
La cinetica
La costante di velocità
Si consideri una reazione irreverisbile A — ›B. Questa sarà del primo ordine, dal momento che c'è un solo reagente.
La velocità v è data dalla velocità con cui scompare il reagente o con cui si forma il prodotto.
![]() La
La
velocità di reazione è, ponendo k=costante di velocità
Per una reazxione del tipo A + B —› prodotti, v = k[A][B], se la velocità è del secondo ordine.
Teoria della velocità di reazione
Quali sono i fattori che determinano la vecloità di reazione? Per ogni reazione esiste uno stato di transizione ad alta energia attraverso cui i reagenti devono passare affinchè la reazione avvenga. La barriera energetica DGo# determina la velocità di reazione k=Q*exp (-DGo#/RT).
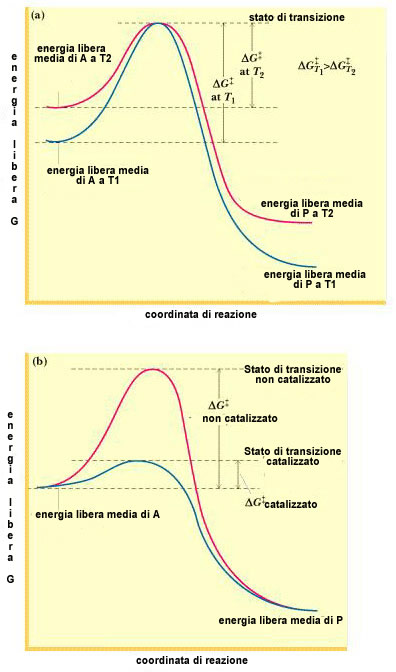
La catalisi
Un catalizzatore funziona perchè è capace
di abbassare l'energia di attivazione di un reagente di una quantità
pari a DGo‡ senza alterare
il DG della
reazione.
Dal momento che DGo‡
= DHo‡ -TDSo‡,
un catalizzatore può accellerare una reazione influendo o DHo‡
oDSo‡, od entrambi. Un legame
forte dello stato di transizione al catalizzatore abbassa
DHo‡ rendendolo più negativo.Orientamento
e la prossimità del substrato sul catalizzatore favoriscono lo
stato di transizione perchè riducono DSo‡.
Gli enzimi
Sono dei catalizzatori altamente efficaci capaci di condurre reazioni complesse in condizione blande di pressione, temperatura, pH.
Mostrano una grande specificità rispetto alla reazione catalizzata
e al substrato con cui reagiscono e mostrano il vantaggio di poter essere
regolati e modulati.
Espletano il loro ruolo catalitico legando specificatamente il substrato
in una zona specifica della proteina, denominata sito catalitico o
sito attivo, costituito dalle catene laterali di varie decine di amminoacidi.
Contengono piccole molecole organiche non proteiche denominate coenzimi,
derivati da vitamine, che prendono parte alle reazioni catalizzate.
| |
|
|
| Biotina |
Biotina |
Carboxssilazione |
| Cobalamina |
B12 |
Alchilazione |
| Coenzima A |
Acido pantotenico |
Trasferimento di un acile |
| Flavina |
Riboflavina |
Redox |
| Acido Lipoico |
Lipoamide |
Trasferiomento di un acile |
| Nicotinamide |
Niacina |
Oxidation-Reduction |
| Pyridoxal Phosphate |
Pyridoxal |
Trasferimento di un NH2 |
| Tetraidrofolato |
Folato |
Trasferimento di un C |
| Tiamina pirofosfato |
Tiamina |
Trasferimetno di un gruppo aldeidico |
Riepilogo dei fattori che causano un aumento della velocità come vista nella cinetica enzimatica.
Una reazione non catalizzata in soluzione può essere lenta perchè
- prevede la formazione di una separazione sfavorita di cariche nello stato di tranzione
- richiedono che più molecole siano messe assieme con una concomitante diminuzione di entropia.
Queste difficoltà sono superate dall'enzima poichè
- pongono in posizione strategiche acid, basi, ionbi metallici o dipoli, che sono parti costitutuenti dell'enzima stesso, per stabilizzare le cariche.
- viene usata la catalisi covalente per conferire alla reazione un percorso a più bassa energia.
- Le perdite di entropia sono minimizzate perchè i gruppi catalitici necessari fanno parte dello stesso enzima.
Queste caratteristiche hanno un prezzo:
- la sintesi di un enzima è altamente energetica anche se lo stesso enzima è riusato più volte
- L'energia di legame enzima substrato viene usata per immobilizzare il substrato nel sito attivo e mantenerlo in prossimità del gruppo catalitico.
