Calore specifico e latente
Calore latente di fusione
Lo scopo principale di questa sezione è quello di provare come il calore ceduto a un corpo non sempre implichi un aumento di temperatura. L'eccezione è costituita dai cambiamenti di stato. Quando noi forniamo calore a un blocco di ghiaccio, la temperatura del ghiaccio aumenta fino ad arrivare a 0°C. Se forniamo ulteriore calore notiamo che la temperatura del ghiaccio non aumenta ma rimane costante. In questa fase infatti il calore fornito serve per far fondere il ghiaccio.
Quando tutto il ghiaccio è fuso, il calore che forniamo all'acqua serve di nuovo per aumentare la sua temperatura finché arriviamo a una temperatura di 100°C. A quel punto il calore ulteriore che cediamo serve al nuovo cambiamento di stato, da liquido a gas. In questa fase di nuovo la temperatura rimane costante finché tutta l'acqua non è passata allo stato gassoso. L'andamento della temperatura T in funzione del calore Q è riportato nel seguente grafico:
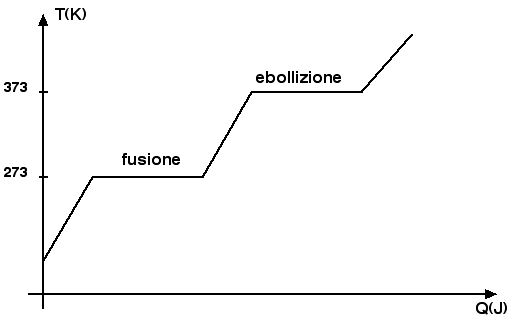
Dopo questa introduzione qualitativa cerchiamo di capire quanto calore serve per far fondere una massa m di ghiaccio o di una qualunque sostanza allo stato solido. È abbastanza intuitivo che questo calore risulta tanto maggiore quanto maggiore è la massa m di sostanza da fondere. In particolare, il calore di fusione Q e la massa m sono direttamente proporzionali Q = Lf · m. Il coefficiente di proporzionalità prende il nome di calore latente di fusione e dipende dalla sostanza che prendiamo in esame. Dal momento che Lf = Q / m la sua unità di misura nel Sistema Internazionale è il J / kg. Nel caso particolare dell'acqua abbiamo che Lf = 3.34 · 105 J / kg. Questo significa che, a pressione atmosferica, per fondere 1 kg di ghiaccio servono 3.34 · 105 J.
È importante precisare

