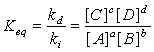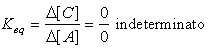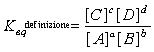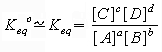CINETICA CHIMICA III
Cinetica in caso di equilibrio chimico
Reazioni complete
La trattazione relativa alla cinetica vista nelle pagine cinetica I e
cinetica II si applica bene nelle reazioni che arrivano a completamento
ossia nelle reazioni esplosive e in tutte le reazioni per un qualche motivo irreversibili.
Infatti si osserva che all'inizio la reazione ha una certa velocità indicata come v0
che si annulla alla fine della reazione per assenza di concentrazione dei reagenti, quindi per la
reazione generale indicata come a A + b B —» c C + d D possiamo applicare sia la formula
vreaz = - Δ[A]/Δt
che la formula relativa alla legge cinetica
vreaz = k • [A]α • [B]β
senza alcun problema teorico matematico, o sperimentale, ma l'aspetto va approfondito nel caso d
elle reazioni all'equilibro!
Reazioni all'equilibrio
Nel caso delle reazioni all'equilibrio vi è una palese contraddizione tra la prima formula
che possiamo chiamare classica vreaz. = - Δ[A]/Δt
e quella della legge cinetica
vreaz = k • [A]α • [B]β
Infatti nelle reazioni dove si arriva ad un'equilibrio tra reagenti e prodotti si riscontra che,
arrivati all'equilibrio, non si ha più alcuna variazione nella concentrazione dei reagenti
o dei prodotti e che quindi la prima formula dove al numeratore compare Δ[A] che all'equilibrio
risulta Δ[A]=0 e di conseguenza il valore vreaz == 0
mentre la seconda essendo direttamente proporzionale alla concentrazione dei reagenti non si annulla
ma risulta vreaz. =/= 0 in quanto K essendo una costante diversa da zero non diventa nulla
e [A] o la [B] risultano entrambe diverse da zero.
Dov'è la contraddizione?
1) Nel primo caso osserviamo l'evolversi della reazione da un punto di vista "esterno" possiamo dire
macroscopico; è come se in un esperimento di fisica volessimo misurare la velocità di un corpo
(per esempio una automobile) che si sposta osservando lo spazio che percorre.
2) Nel secondo caso osserviamo l'evolversi della reazione da un punto di vista "interno" possiamo dire
microscopico, di urti tra le particelle; è come se in un esperimento di fisica volessimo misurare
la velocità di un corpo (per esempio una automobile) attraverso il suo tachimetro o contachilometri.
I due aspetti risultano complementari e analoghi nel caso delle reazioni irreversibili.
Nel caso di equilibri chimici invece, come già sottolineato, interviene una contraddizione,
possiamo quindi immaginare, sempre tenendo valido come esempio la misura della velocità di un'automobile
che nel caso di reazioni all'equilibrio l'automobile si muova su un tapis roulant o su un terreno fangoso,
in tali condizioni un osservatore "esterno" vedrà l'automobile ferma o quasi,
mentre un osservatore "interno" guardando il tachimetro continuerà a misurare una velocità
esattamente quella generata dal movimento del motore alle ruote.
Riassumiamo quanto detto nel seguente specchio:
REAZIONE IRREVERSIBILE
| REAZIONE REVERSIBILE o all'equilibrio |
| punto di vista "assoluto" |
punto di vista "relativo" |
| automobile che si muove nello spazio |
automobile che si muove su un tapis roulant |
| nessuna contraddizione tra la misura della velocità di un osservatore esterno e quello del pilota dentro l'automobile |
contraddizione tra la misura della velocità di un osservatore esterno e quello del pilota dentro l'automobile |
Quindi quale approccio usare? La risposta dipende ovviamente dalla preferenza che si dà al caso 1) o al caso 2);
personalmente opto per il primo caso essendo quello macroscopico che dà meno adito a dubbi.
Analisi della costante di equilibrio
Nella trattazione classica della costante di equilibrio così come si ritrova nella maggior parte
dei libri di testo si parte dalla relazione che all'equilibrio:
vreaz. diretta (ossia reagenti —» prodotti) = vreaz. inversa (ossia prodotti —» reagenti)
vdiretta = kd• [A]α • [B]β = vinversa = ki• [C]γ • [D]δ
Quindi gli autori procedono applicando la 2), uguagliando senza alcuna spiegazione gli esponenti α = a, β = b, γ = c e δ = d.
Così da ritrovare alla fine la formula classica per la costante di equilibrio
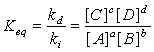
possiamo proseguire lo specchio ed evidenziare che in entrambi i casi si arriva teoricamente allo stesso risultato.
REAZIONE REVERSIBILE caso 1)
all'equilibrio |
REAZIONE REVERSIBILE caso 2)
all'equilibrio |
| punto di vista "esterno" alias macroscopico |
punto di vista "interno" alias microscopico |
| vreaz = - Δ[A]/Δt == 0 |
vreaz = k • [A]α • [B]β =/= 0 |
| vdiretta = vinversa == 0 |
vdiretta = vinversa =/= 0 |
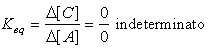 |
 |
all'equilibrio ovviamente saranno
[A], [B] , [C] e [D] fissate e in relazione tra di loro |
assumiamo arbitrariamente poiché non
dimostrabile se non in casi particolarmente semplici
α = a, β = b, γ = c e δ = d |
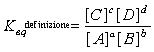 |
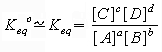 |
In entrambi i casi si sono operate pesanti approssimazioni e assunzioni che poco hanno a che vedere
con la cinetica o con passaggi matematicamente esatti. In entrambi i casi possiamo trovare aspetti
didatticamente utili.
A Voi la scelta
Bibliografia
Adolfo Ferrari "Trattato di chimica generale ed inorganica" 1965
Aurora Allegrezza, Marilena Righetti, Fabio Tottola "Introduzione alla chimica" Mondadori scuola 2014
Massimo Crippa, Donatella Nepgen "Al centro della chimica" II edizione Le Monnier scuola 2015
|