CINETICA CHIMICA I
La cinetica chimica, analogamente alla cinetica fisica, studia la velocità di un fenomeno.
Nel caso della cinetica chimica si studia la velocità di trasformazione di un reagente in un prodotto
o per meglio dire la variazione della quantitagrave;/concentrazione di un reagente o di un prodotto nel tempo.
In una reazione che procede da reagenti verso prodotti, la quantitagrave; dei reagenti diminuirà nel
tempo mentre aumenterà la quantità dei prodotti.
Per deifnizione la velocità di una reazione si definisce come la variazione della concentrazione
dei reagenti o meglio di un reagente (espressa in molarità) nel tempo ossia come la variazione
della concentrazione dei prodotti (espressa in molarità) nel tempo.
Dovendo necessariamente tenere in considerazione i coefficienti stechiometrici per una generica reazione del
tipo:
a A + b B —» c C + d D
e definendo la velocità in termini di variazione come indicato precedentemente, con segno positivo
(come in genere si procede all'inizio della trattazione della cinetica), abbiamo:
vreaz. = - Δ[A]/Δt
oppure
vreaz. = + Δ[C]/Δt
Dove con Δ indichiamo la variazione intervenuta in un certo tempo Δt ossia prendento Δt
= t2 - t1 avremo una variazione di concentrazione misurata al tempo t2 meno quella
misurata al tempo t2 corrispondente a:
Δ[A] = [A]t2 - [A]t1
Appare subito evidente come, per eguagliare le velocità di reazione dobbiamo tenere in considerazione
anche i coefficienti stechiometrici quindi possiamo scrivere più intelligentemente per un sistema
a volume costante:
vreaz = -(Δ[A]/a)/Δt = -(Δ[B]/b)/Δt = +(Δ[C]/c)/Δt
= +(Δ[D]/d)/Δt
Come nella cinetica fisica possiamo avere diversi andamenti per la velocità di una reazione.
Per comprendere meglio i diversi andamenti si costruiscono a coppie grafici della concentrazione [A] per
esempio, in funzione del tempo, nonché i relativi grafici del rapporto -Δ[A]/Δt
la variazione della concentrazione
in funzione sempre del tempo.
reazione più comune che procede con discesa esponenziale
della concentrazione dei reagenti nel tempo.
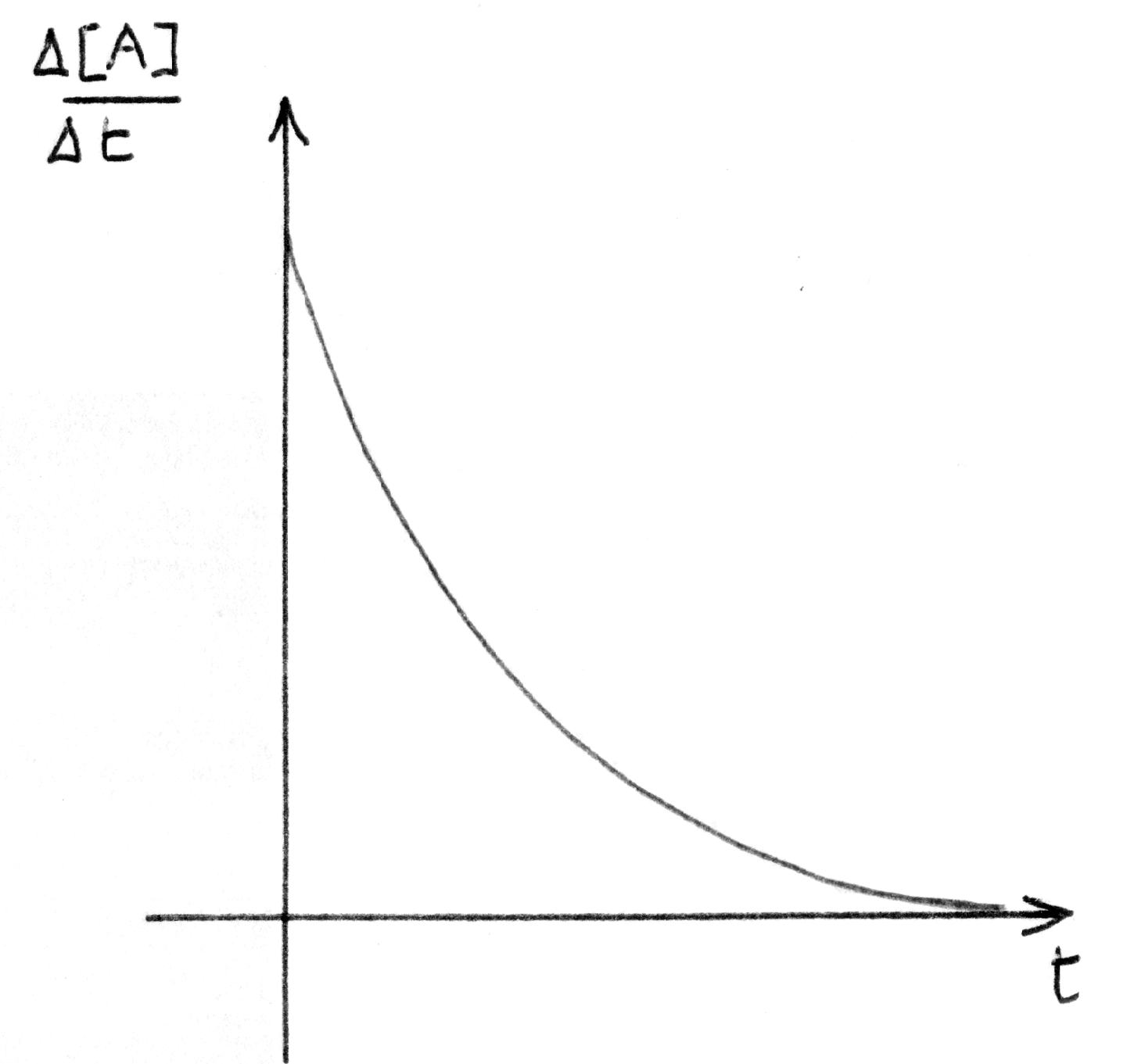
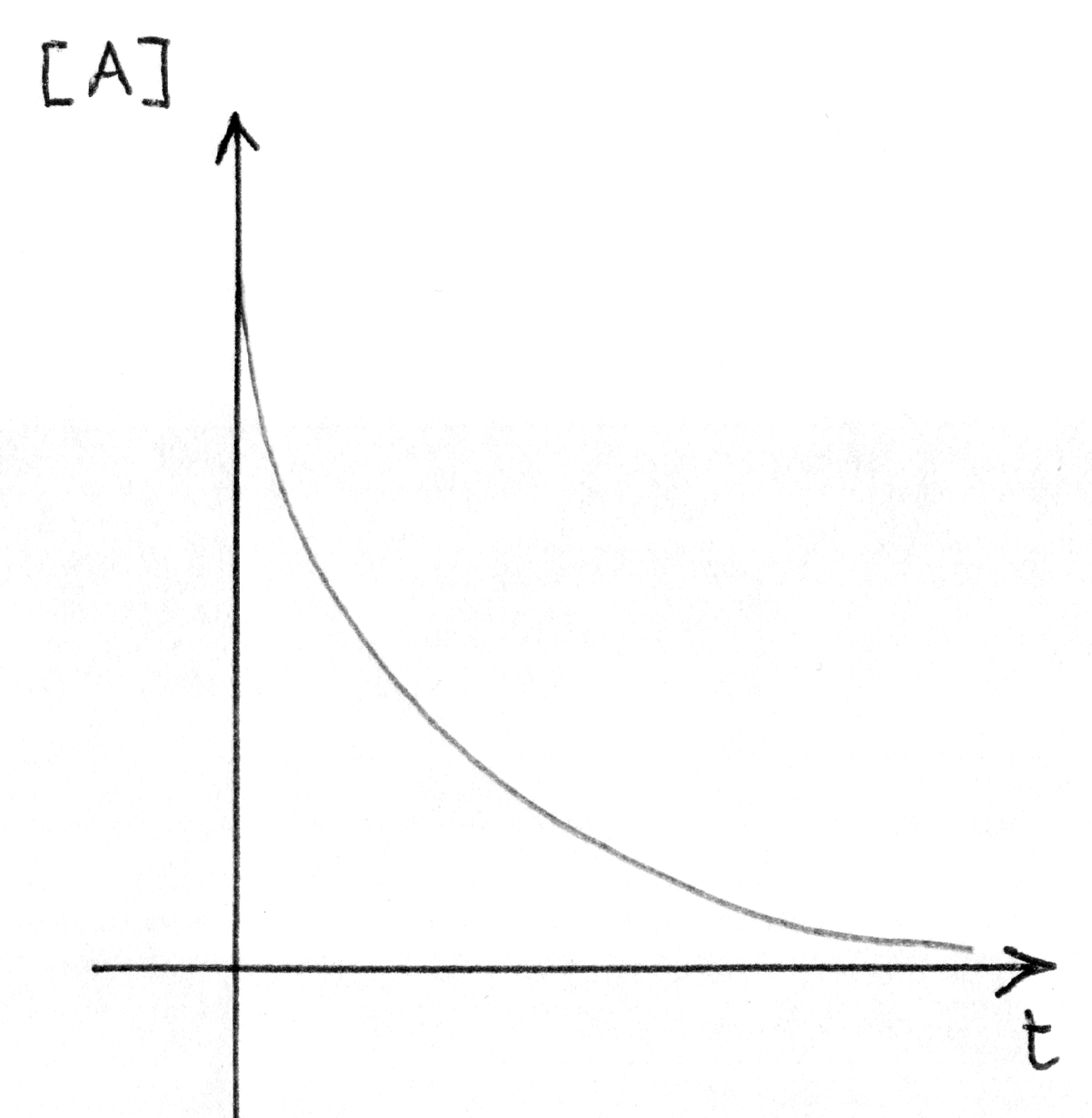 |
grafico della velocità di reazione relativo al caso di sinistra.
 |
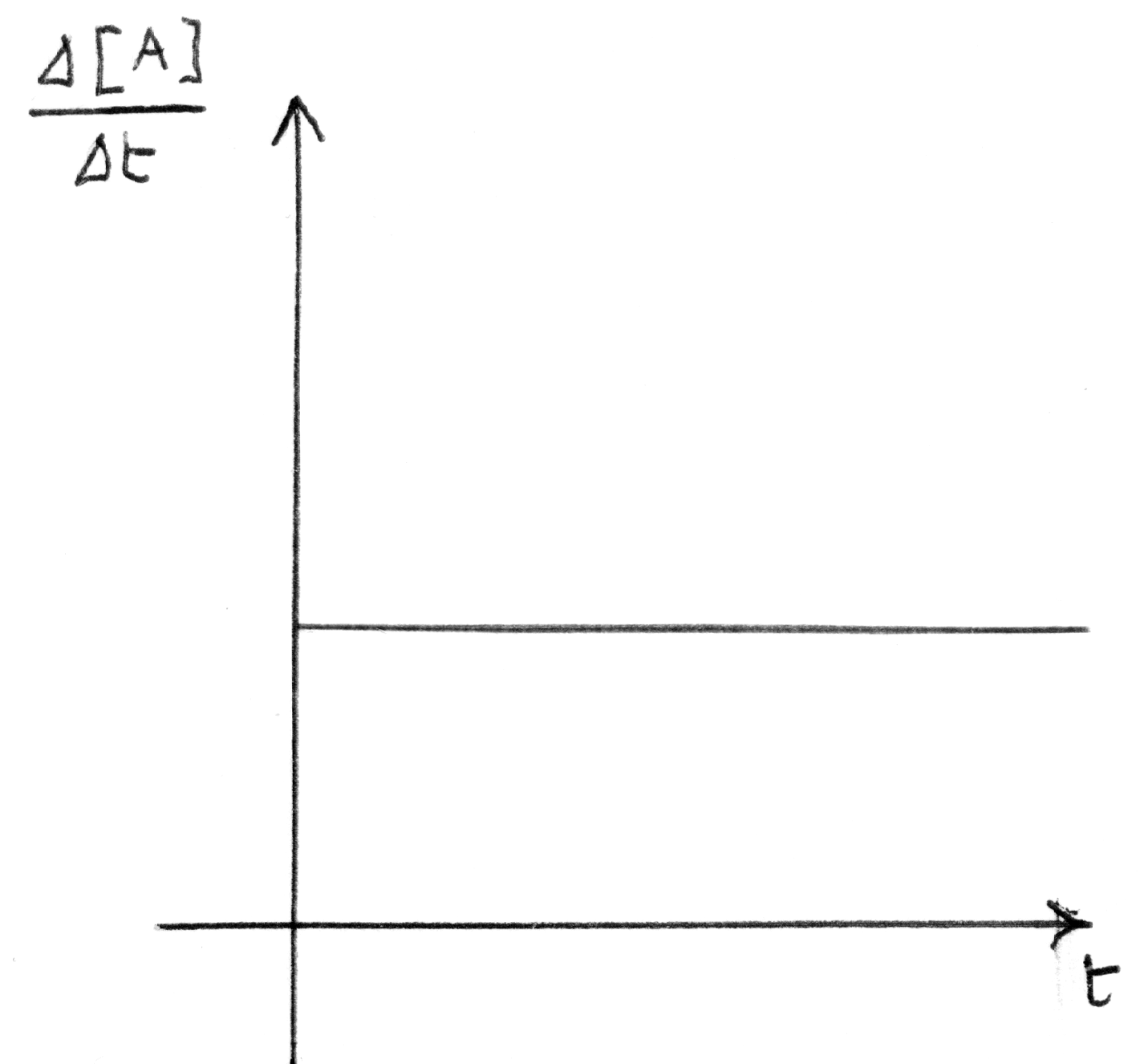
reazione che procede con discesa regolare o lineare della con-
centrazione dei reagenti nel tempo.
 |
grafico della velocità di reazione costante relativo al caso di
sinistra.
 |
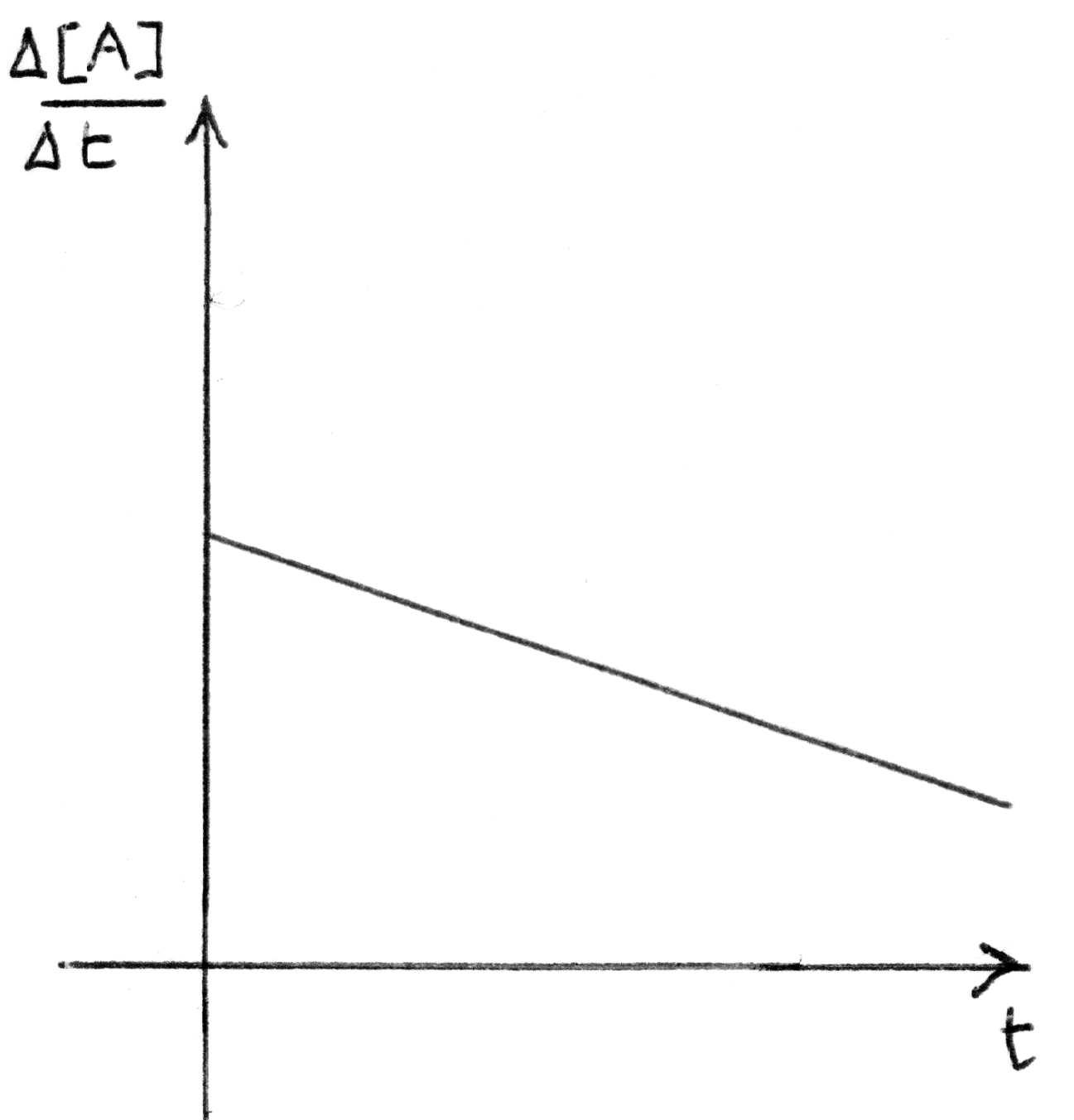
reazione che procede con discesa progressiva della concen-
trazione dei reagenti nel tempo.
 |
grafico della velocità di reazione relativo al caso di
sinistra che procede con velocità di reazione che diminuisce
regolarmente col tempo.
 |
reazione oscillante che procede con oscillazioni nella
concentrazione dei reagenti nel tempo.
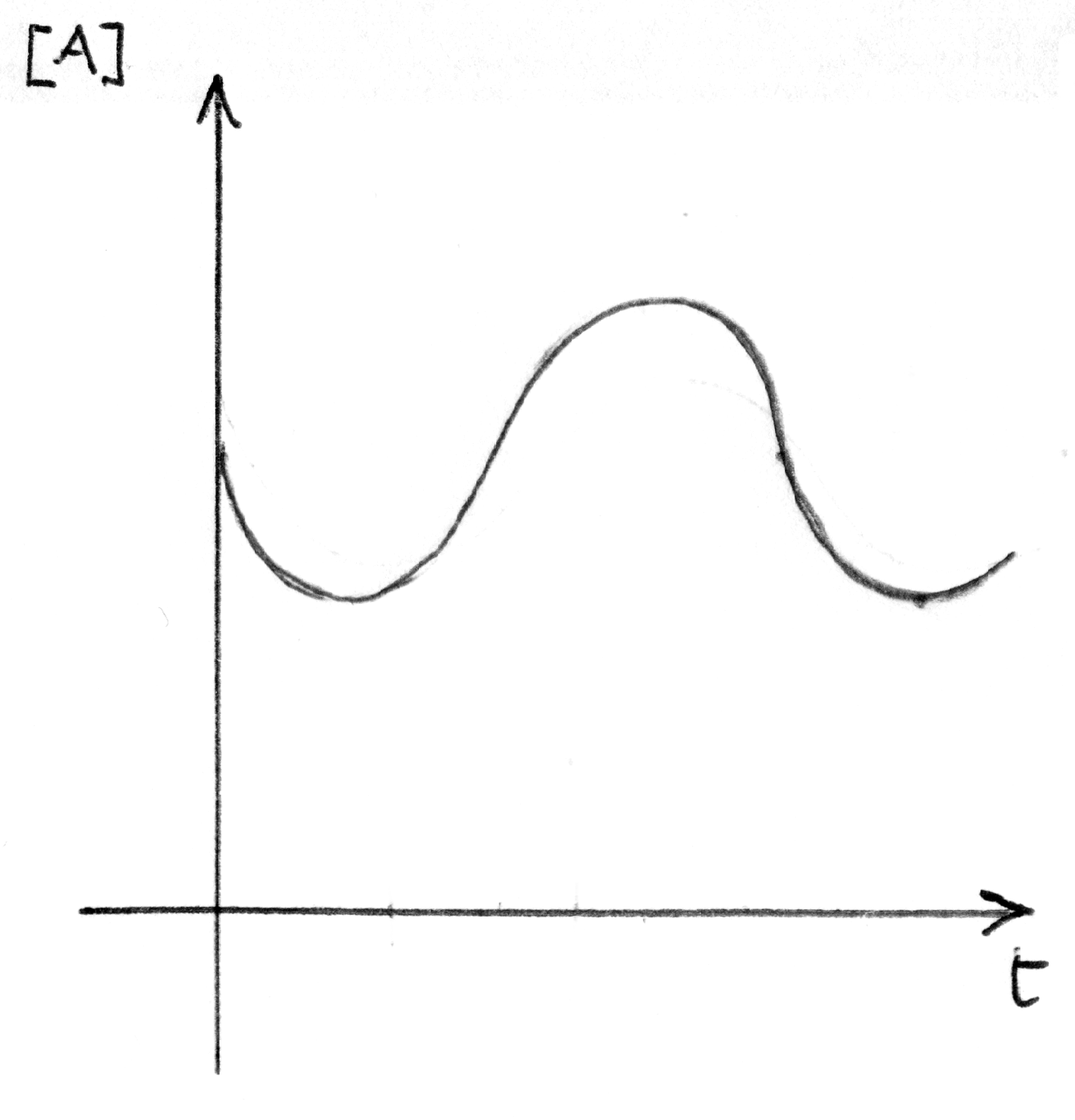 |
grafico della velocità di reazione oscillante relativo al caso
di sinistra.
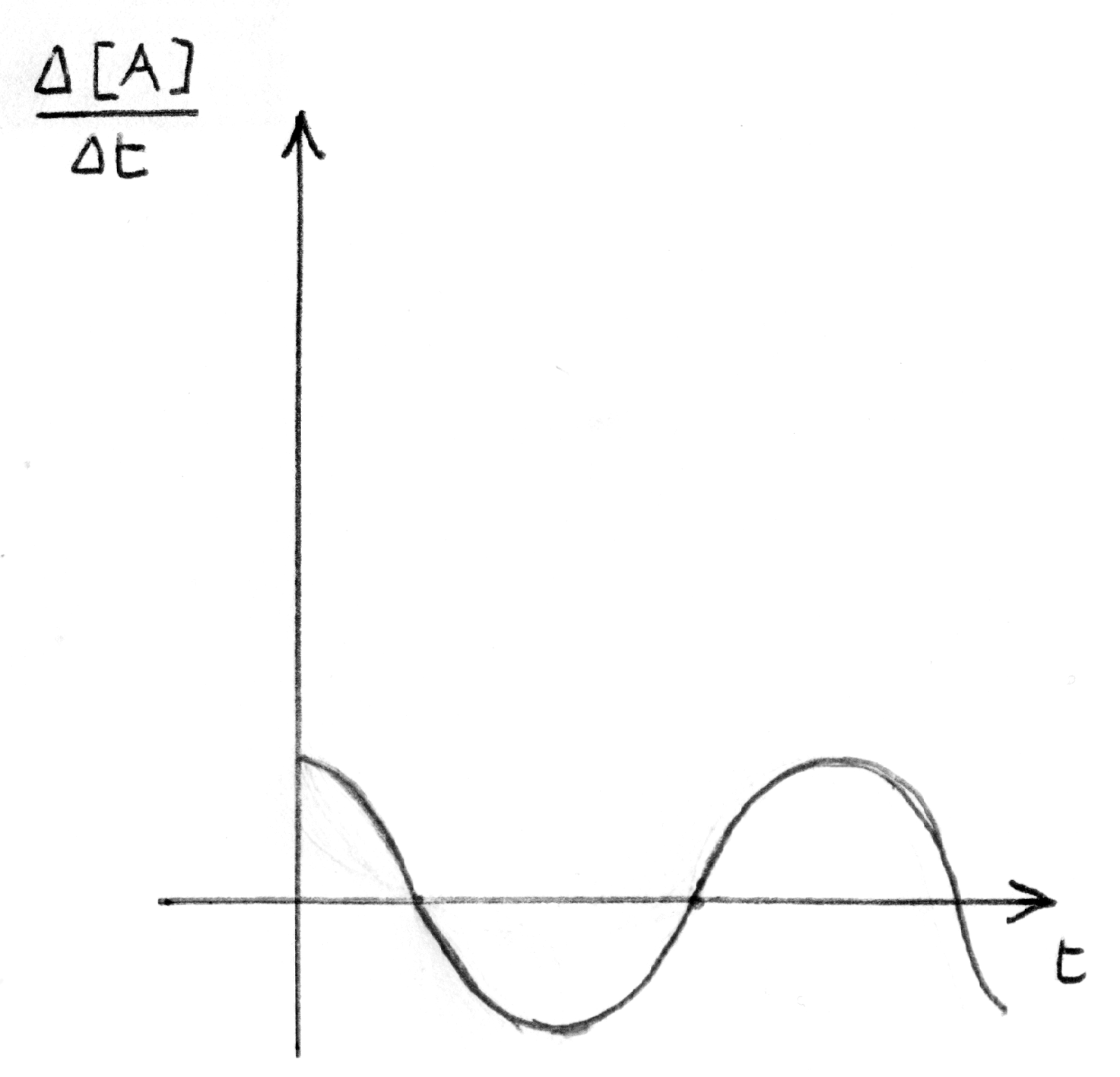 |
reazione esplosiva o a catena che procede con discesa
rapidissima della concentrazione dei reagenti nel tempo
(è un caso particolare della reazione più comune).
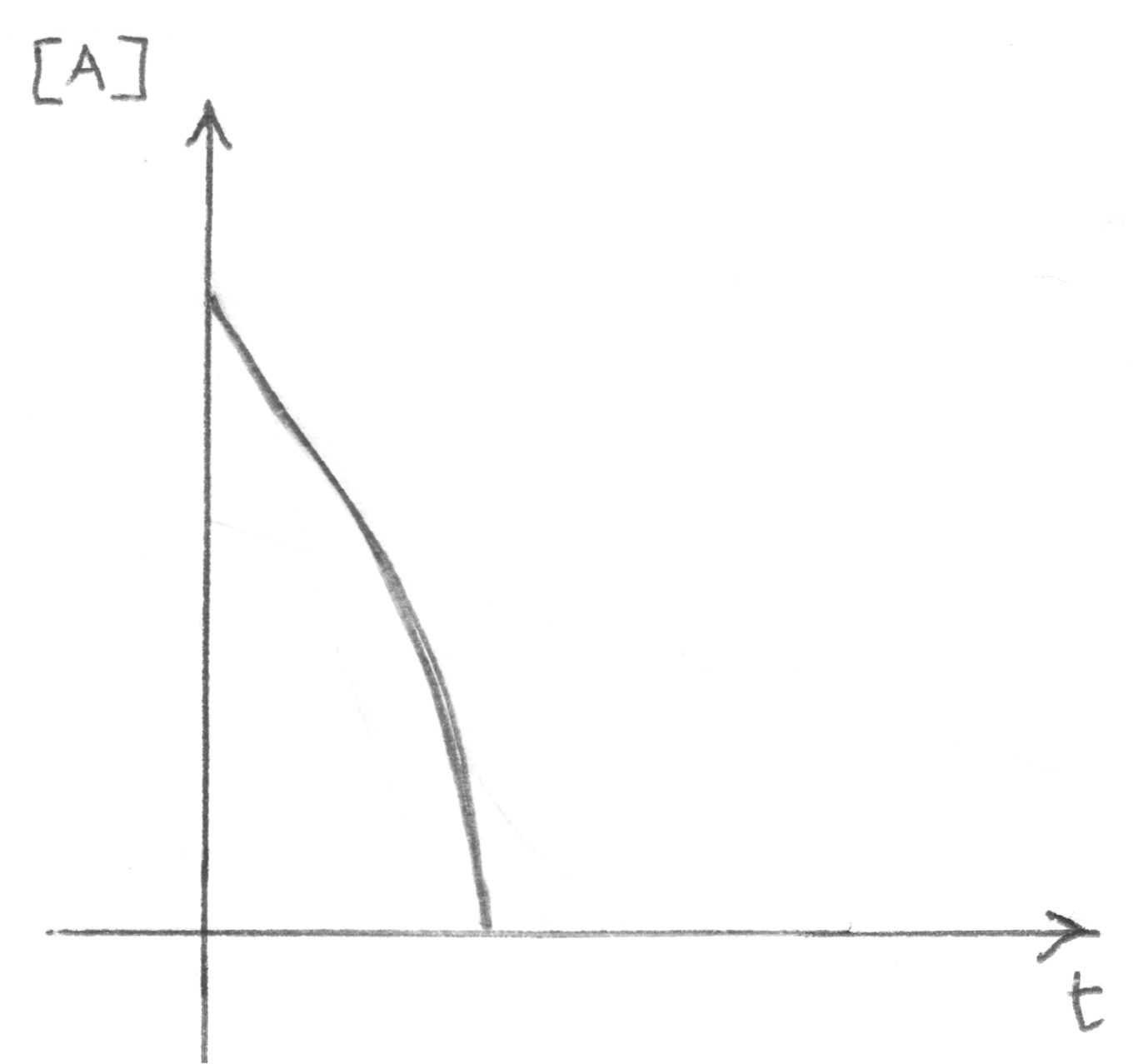 |
grafico della velocità di reazione relativo al caso di sinistra.
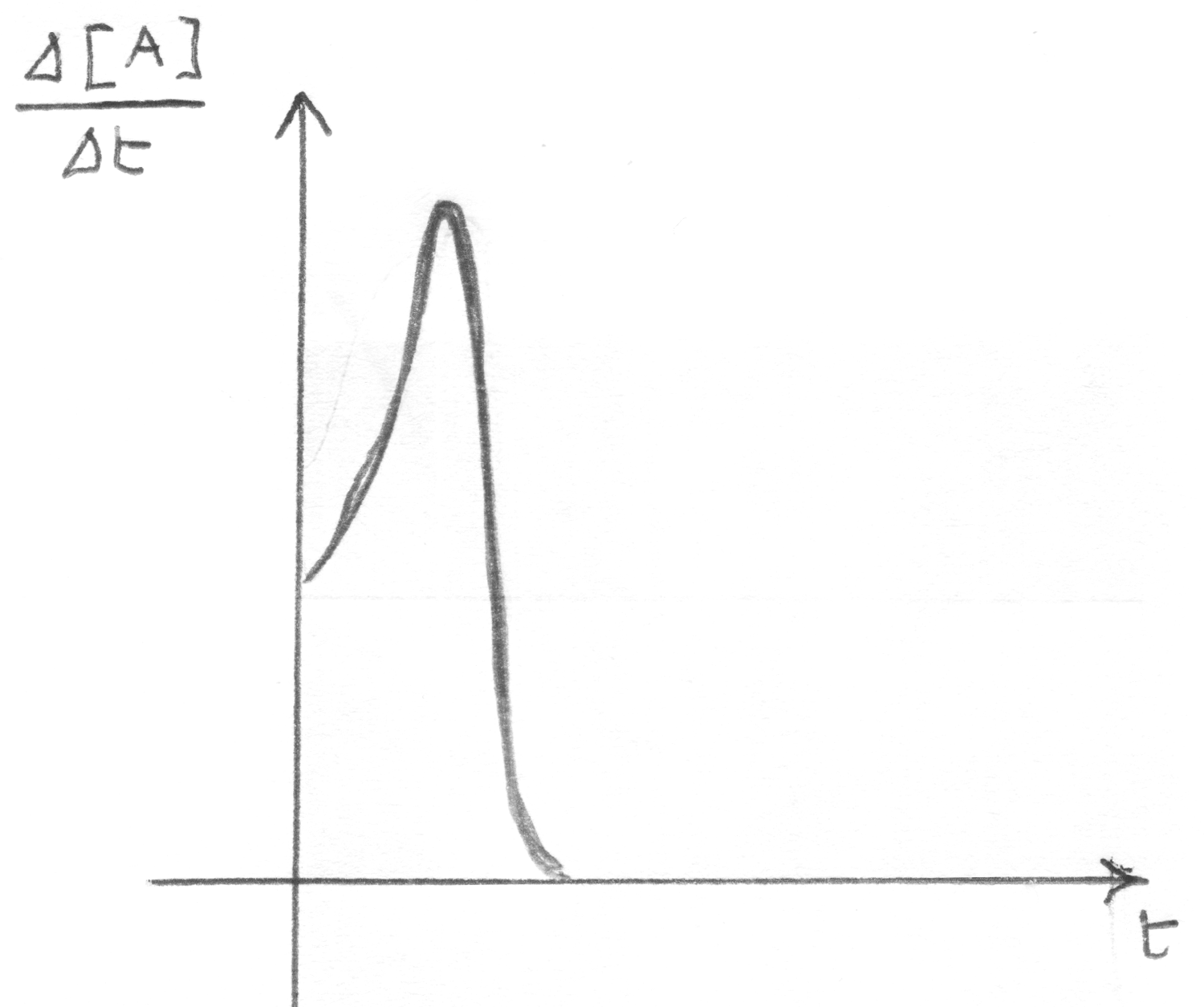 |
Per procedere con la cinetica studiare la pagine di cinetica II e
cinetica III; per applicare quanto studiato consultare la pagina
sperimentale relativa alla cinetica di combustione.
Bibliografia
S. Passananti, S. Ponente, C. Sbriziolo “Principi di chimica” Tramontana 2000
Adolfo Ferrari "Trattato di chimica generale ed inorganica" 1965
|











