"I doppi legami"
 |
In alcuni casi la regola dell'ottetto può essere soddisfatta creando legami multipli tra due atomi. Nella formaldeide si ha la formazione di tre legami tra il C con 2 H ed 1 O, il che lascia un elettrone ail C e 5 per l'O. Si potrebbe spostare un elettrone da un atomo all'altro, lasciando nel contempo una deficienza di elettroni sull'atomo che perde l'elettrone, ma possiamo disegnare un altro legame tra C ed O, mentre sull'O riamngono due doppietti solitari. Questo lascia aperto il discorso sulla natura del doppio legame e sulle sue implicazioni sulla struttura 3D, se è uguale ad i precedenti e se crea repulsioni ulteriori. Questa discussione richiede che se ne parli all'interno della teoria degli Orbitali Molecolari, in quanto la VSEPR è per gran parte empirica e spesso si derivano regole sulla base di geometrie note. La formaldeide è planare come l'etilene e in apparenza i tre legami del C determinano la struttura planare e gli angoli di 120°. Il secondo doppio legame è in qualche modo esterno al piano. Un altro esempio esemplificativo è lo ione solfato SO42- mostrato sulla destra. Lo S ha 6 elettroni, l'ossigeno anche. Tenendo in mente che l'O rispetta la regola dell'ottetto e che S può avere più di 4 doppietti, si possono ricavare molte strutture di Lewis. Ne mostriamo solo 3. Ogni legame S-O può essere singolo, con O negativo, o doppio con l'O neutro. Se disegnassimo tutte le pssibilità arriveremmo alla conclusione che i 4 O sono equivalenti e che perciò la struttura deve essere tetraedrica. |
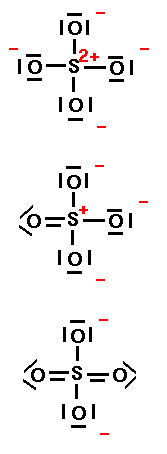 |
aaaa
aaaa
aaaa
