"Struttura di Lewis e 3D"
Per disegnare le strutture secondo Lewis si fanno i seguenti passaggi:
1- Si contano gli elettroni di valenza di ogni atomo, che sono pari al numero del gruppo di appartenenza nella Tavola Periodica. Si tiene conto che il numero massimo di orbitali del guscio di valenza (VSO) per un atomo è pari al quadrato del periodo di appartenenza. Per esempio N ha 5 elettroni (Vgruppo) e può formare massimo 4 doppietti (tra legami e doppietti) come per C O ed F(periodo 2). Per P, ad esempio, il numero massimo VSO è 9 ed infatti ha 9 orbitali sull'ultimo guscio di valenza.
2- Si sistemano gli atomi in maniera opportuna tenendo conto che O può dare solo 2 legami oppure 3 con una carica +, H uno, F uno. Quindi l'atomo che dà più legami è detto atomo centrale.
3- Si disegnino i legami singoli che l'atomo centrale fa e gli eventuali doppi legami tra elettroni non accoppiati tra l'atomo centrale e quelli periferici.
4- Si sistemino i doppietti elettronici solitari eventualmente avanzanti per ogni atomo. Si tenga conto che gli atomi del 2 periodo tranne B completano sempre il guscio di valenza arrivando a tenere attorno a sè 8 elettroni, mentre gli elementi del 3 periodo possono anche avere più di 4 doppietti come P e S.
5- Si tenga riarrangino i doppietti eventualmente per tener conto della carica formale eventualmente presente. Si tenga conto che la carica negativa è distribuita sugli atomi più elettronegativi,
Applicando quanto detto finora ad alcuni composti con H si avrà:
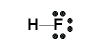

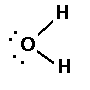
Per la forma tridimensionale si può dare un'occhiata alla pagina sul VSEPR
