L'acqua
introduzione
L'acqua non è soltanto il 70-90% del peso della maggior parte delle forme di vita, ma rappresenta
anche la fase continua degli organismi viventi. Poiché è familiare e ubiquitaria, l'acqua è
spesso considerata un liquido blande e inerte, con l'unica funzione di riempire gli spazi vuoti degli
organismi viventi. In realtà è una sostanza reattiva che possiede delle proprietà insolite
che la distinguono nettamente dalla maggior parte degli altri liquidi comuni. Oggi sappiamo che l'acqua e
i suoi prodotti di ionizzazione (gli ioni idronio H9O4+ e ossidrile
H7O4-) sono molto importanti nel determinare la caratteristica struttura
e le proprietà biologiche delle proteine e degli acidi nucleici, oltre che delle membrane, dei ribosomi e
di molti altri componenti cellulari.
proprietà fisiche e chimiche
A temperatura e pressione ambientale (20°C, 1 atm) l'acqua si presenta come un liquido inodore, insapore,
incolore se in strati sottili, è azzurrognola in masse superiori ai sette metri di altezza; allo stato
naturale contiene sempre disciolti numerosi sali, aria ed altre sostanze.
Gli antichi la credettero un corpo semplice e la considerarono insieme al fuoco, all'aria ed alla terra
una delle quattro sostanze fondamentali e semplici dell'universo.
La molecola dell'acqua ha formula H2O contiene due atomi di idrogeno ed uno di ossigeno legati
da un legame H-O covalente polare con distanza di 0,96 amstrong ed angolo di legame H-O-H di 104,5°.
A causa dei valori di elettronegatività dei singoli atomi sull'ossigeno si concentra una parziale
carica negativa mentre sugli idrogeni una parziale carica positiva che generano delle forze intermolecolari
di natura elettrostatica chiamate legame idrogeno con energia di legame pari a a 4,5 kcal/mole (da
confrontare con il valore di 110 kcal/mole per il legame covalente O-H) e con lunghezza pari a 1,77 armstrong
(nel ghiaccio).
L'acqua ha un punto di fusione, un punto di ebollizione, un calore di vaporizzazione, un calore di fusione
ed una tensione superficiale (ovvero la tendenza ad evaporare allo stato liquido) più elevati di quelli di
idruri simili come H2S o NH3 (l) o anche della maggior parte dei liquidi comuni.
Tutte queste proprietà indicano che le forze di attrazione fra le molecole dell'acqua liquida, e quindi la
sua coesione interna sono relativamente elevate.
proprietà solventi
Tra i liquidi comuni l'acqua è quella ad avere la più alta polarità. Se consideriamo altri liquidi comuni
come benzene, cloroformio, mercurio, bromo, olio hanno tutti struttura apolare e risultano insolubili in
acqua, mentre altri quali acetone, alcool etilico, alcool metilico che rono parzialmente polari risultano
solubili chi piuù chi meno nell'acqua.
| liquido | polarità o costante dielettrica | calore di vaporizzazione in cal/g a 1 atm. |
| acqua | 80 | 540 |
| alcool metilico | 33 | 263 |
| alcool etilico | 24 | 204 |
| acetone | 21,4 | 125 |
| benzene | 2,3 | 94 |
| cloroformio | --- | 59 |
| esano | 1,9 | --- |
La compartimentazione
Una delle proprietà che risulta di maggior interesse per la biologia è quella della immiscibilità
dei grassi. La natura ha quindi operato affinché determinati lipidi formassero la membrada alle cellule viventi.
Questo ha creato una asimmetria nel sistema prima omogeneo, che è indispensabile per lo sviluppo di particolari
funzioni dei viventi.
salinità dei mari
La maggior aprte dell'acqua sulla crosta terrestre è però salata tanto che l'acqua dolce si
può ben considerare a tutti gli effetti un bene estremamente prezioso da non sprecare.
Ecco una immagine della salinità dei diversi mari del pianeta terra.
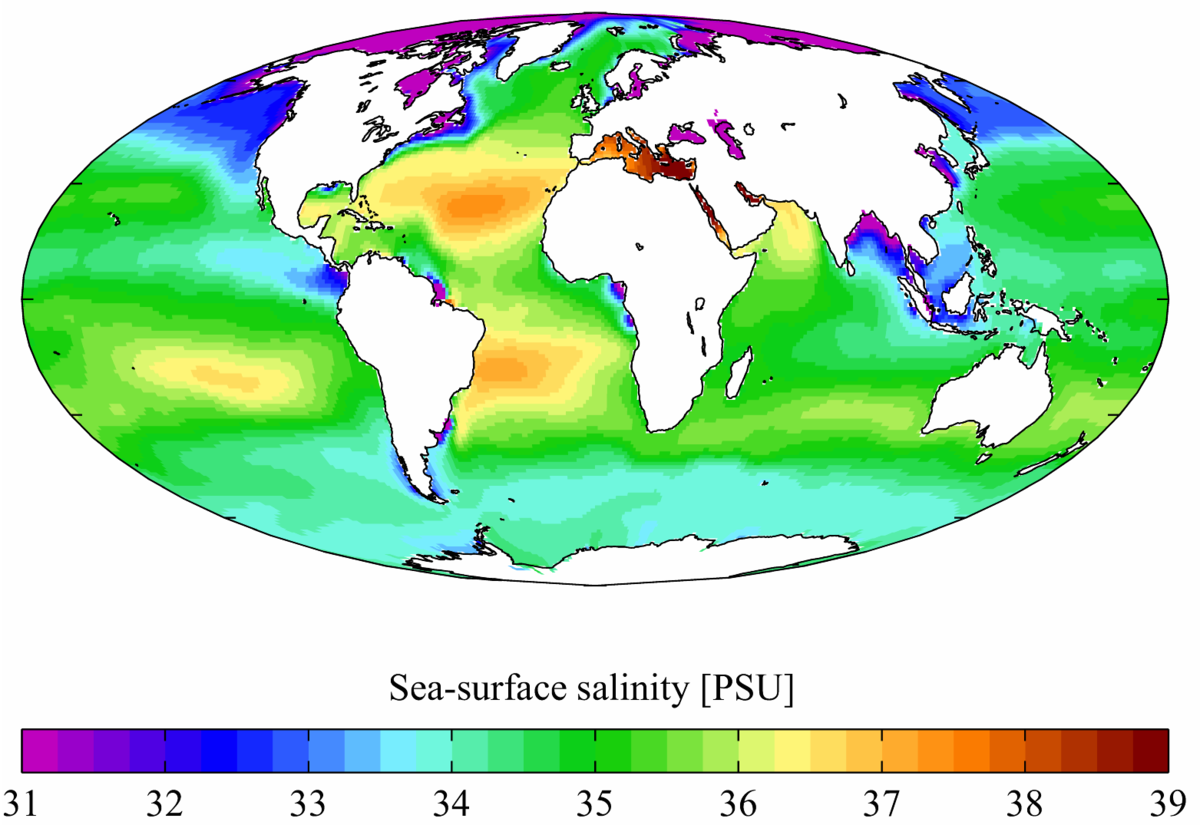
In questa mappa la salinità è espressa come practical salinity unit ossia rapporto tra
la conduttività di un campione di acqua di mare e quella di una soluzione standard di KCl formata
da 32,4356 grammi di sale disciolti in un chilogrammo di soluzione a 15°C (0,435 mol/L).
Bibliografia
Albert H. Lehninger "Biochimica" II ed. Zanichelli
|