CINETICA DI REAZIONE permanganato di potassio con acido ossalicoPrerequisiti.La reazione tra permanganato di potassio e acido ossalico e la sua natura catalitica sono note fin dal 1866, ma il meccanismo di reazione appare ancora poco chiaro e diversi autori nel corso del tempo hanno sviluppato varie ipotesi.La reazione di ossidoriduzione complessiva risulta: 2 MnO4-(aq) + 6 H+(aq) + 5 H2C2O4(aq) —» 2 Mn++(aq) + 8 H2O(aq) + 10 CO2(g) Lo ione manganoso (Mn++) risulta inoltre un catalizatore della reazione secondo un meccanismo ancora sconosciuto.
Materiale e strumenti.In laboratorio saranno presenti:
Per quanto riguarda l'attrezzatura e la strumentazione daranno presenti:
Procedimento.Sarà cura di ogni studente completare le seguenti tabelle al fine di osservare la cinetica di reazione, questa sarà misurata in termini semi-quantitativi osservando la variazione di colore da viola a incolore che si osserverà nei vari campioni.
Questa prova è stata fatto dalle classi II^F e II^I dell'I.T.I.S. di Ravenna nell'anno scolastico 2012/13 su proposta della prof.ssa Franca Brusa. I dati ottenuti dallo studente Gaudenzi Marco sono stati per esempio i seguenti:
A che punto siamo?Come scritto sopra diverse sono le proposte di svolgimento della reazione, taluni autori pensano inoltre che il meccanismo possa essere diverso a seconda che sia presente o meno lo ione manganoso come catalizzatore.Altri pensano che durante la reazione possano intervenire dei radicali, altri lo negano, in ogni caso la letteratura sull'argomento risulta sempre abbastanza chiara tanto che può essere letta utilmente anche da non profesisnisti. Un concetto su cui gli autori nons i soffermano è quale forma debbano avere i complessi attivati per fare avvenire la reazione dopotutto per trasmettersi atomi o elettroni le speci chimiche in gioco devono essere in stretto contatto tra di loro, non parliamo infatti di elettrochimica (dove ossidazioni e riduzioni sono mediate dalla presenza nel sistema di reazione di due elettrodi) ma di reazioni in soluzione dove quindi vale fino a prova contraria la teoria degli urti efficaci e del complesso attivato (vedi a tal proposito i diagrammi di Energia in funzione della coordinata di reazione).
Alcuni dati scientifici a disposizione.♣ Conosciamo le costanti di acidità dell'acido ossalico:H2C2O4 = H+ + HC2O4- con K1 = 1,05 • 10-1 [3] HC2O4- = H+ + C2O4-- con K2 = 2,00 • 10-4 [3] ♣ Conosciamo le costanti di acidità dell'acido solforico: H2SO4 = H+ + HSO4- con K1 = > 1000 HSO4- = H+ + SO4-- con K2 = 1,27 • 10-2 [7] ♣ Conosciamo la costante di complessazione dello ione manganico: Mn(C2O4)3--- = Mn(C2O4)2- + C2O4-- con K = 8,75 • 10-4 [3] ♦ La velocità di scomparsa del permanganato sembra seguire una strana cinetica dipendente dalla concentrazione degli ioni manganoso, ossalato e ioni idrogeno del tipo: vreaz. = -d[MnO4]/dt = k [Mn++]1 • [C2O4]2 • [H+]-2 • [MnO4]1 [5]
Vediamo di riassumere alcune delle nozioni sicure riportate nella letteratura scientifica riguardo questa reazione
e i possibili intermedi:
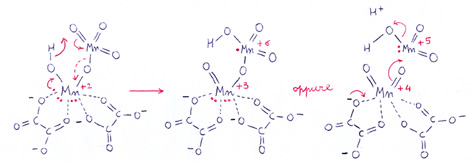
Mn++(aq) + F-(aq) —» MnF4--(aq) inibendo così la reazione complessiva. Un ipotetico passaggio di ossidoriduzione diretta tra il permanganato e l'ossalato del tipo: MnO4-(aq) + 4 H+(aq) + 2 H2C2O4(aq) —» 2 Mn+++(aq) + 4 H2O(aq) + 4 CO2(g) non risulta quindi il meccanismo appropriato [2],[7]. non a caso la reazione prevederebbe uno stato di transizione a sette centri molto raro in chimica così rappresentabile:
d) La maggior parte degli autori 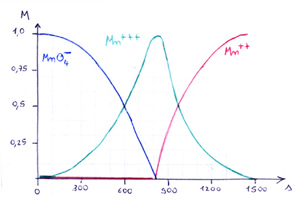 conferma grafici spettrofotometrici del tipo rappresentato a destra
e concordano nel dire che finché il permanganato è presente non appare, anche se aggiunta, la presenza di Mn++. conferma grafici spettrofotometrici del tipo rappresentato a destra
e concordano nel dire che finché il permanganato è presente non appare, anche se aggiunta, la presenza di Mn++.Conclusioni.Il meccanismo di quali speci molecolari collidono o si combinano rimane molto incerto, il sottoscritto, credendo poco nell'esistenza di speci radicaliche in soluzione (peraltro di difficile dimostrazione), pensa di proporre i seguenti due meccanismi o stadi intermedi secondo le seguenti equazioni di reazione. In presenza di sali manganosi abbiamo:1) MnO4-(aq) + Mn++(aq) + 8 H+(aq) + 11/2 C2O4--(aq) —» 2 Mn(C2O4)2-(aq) + 3 CO2(aq) + 4 H2O
Possiamo quindi in base alle nozioni scritte in precedenza supporre un complesso catalitico del tipo [Mn(OH)(C2O4)2(MnO4)]--
che agisce sulle molecole di ossalato in successione con due riduzioni successive portando il permanganato dallo stato +7 allo stato +3.
La reazione procede poi con una cinetica diversa nella rimanente riduzione dello ione manganico fino a sua totale scomparsa:
In assenza di sali manganosi possiamo tentativamente proporre:
Bibliografia generaleAdolfo Ferrari "Trattato di chimica generale ed inorganica" ed. Riccardo Pàtron, Bologna 1965Mark S. Cracolice, Edward I. Peters "Chimica tutto si trasforma" ed. Zanichelli, Bologna 2007
Emerografia scientifica1 Harcourt A.V., Esson W. Philos. Trans. Royal Society (London) 1866, vol. 156, pag. 1932 Launer H.F. e Yost D.M. J. Am. Chem. Soc. 1934, vol. 56, pag. 2572 3 Adler S.J. e Noyes R.M. J. Am. Chem. Soc. 1955, vol. 77, pag. 2036-2042 4 Yamashita S., Hayakawa T. e Toyama O. Bulletin of University of Osaka Prefecture serie A engineering and natural sciences 1957, vol. 5, pag. 131-137 5 Koupparis M.A. e Karayannis M.I. Analytica Chimica Acta 1982, vol. 138, pag. 303-310 6 Kovács K.A., Vizvári Béla, Riedel M. e Tóth J. Phys. Chem. Chem. Phys. 2004, vol. 6, pag. 1236-1242 7 Kovács K.A., Gróf P., Burai L. e Riedel M. J. Phys. Chem. A 2004, vol. 108, pag. 11026-11031
|
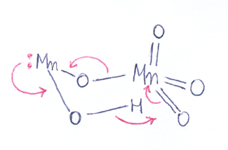

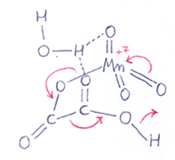

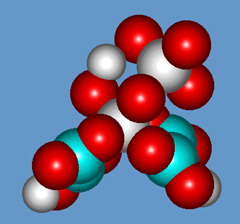 e il meccanismo di reazione potrebbe essere il seguente:
e il meccanismo di reazione potrebbe essere il seguente: