ANALISI DEGLI ZUCCHERI RIDUCENTI
(METODO DI FEHLING)
introduzione
Parliamo della determinazione degli zuccheri riducenti messa a punto da Hermann von Fehling (1812-1885)
nel 1848, all'epoca docente di chimica a Stoccarda.
Si può analizzare da un punto di vista qualitativo come test per la presenza di zuccheri riducenti, sia
da un punto di vista quantitativo, con un metodo volumetrico (titolazione con buretta) o gravimetrico
(determinazione della massa di Cu2O svuiluppata nella reazione di Fehling).
Altri metodi per determinare gli zuccheri sono il metodo densimetrico (con misure di densità), il metodo
rifrattometrico (utilizza il rifrattometro di Abbe, strumento facile, rapido e veloce per avere un primo
indice dello zucchero presente) e il metodo polarimetrico (utilizza un polarimetro).
Ma la metodica ufficiale è il metodo che andiamo a descrivere di analisi volumetrica con il metodo di
Fehling.
Analisi qualitativa
Molti alimenti, di origine sia vegetale che animale, contengono zuccheri riducenti, semplici o complessi:
tra questi possiamo citare la frutta, il miele, il latte.
La presenza di zuccheri riducenti negli alimenti può essere facilmente dimostrata ricorrendo alla reazione
di Fehling, per questo scopo occorre innanzitutto preparare i due reattivi chiamati Fehling A e Fehling B.
Le due soluzioni vanno conservate separatamente, al momento dell'uso si mescolano in parti uguali nella
quantità necessaria per l'esperienza, la miscela delle due soluzioni, che ha un colore blu intenso, deve
essere utilizzata entro non più di 20-30 minuti dalla preparazione.
Per effettuare la prova qualitativa si pone in una provetta 1 mL del liquido in cui si vuol evidenziare
la presenza di zuccheri e si aggiungono 2 mL della miscela preparata.
Si scalda il tutto alla fiamma per alcuni secondi.
In presenza di zuccheri il liquido acquisterà una colorazione variabile tra il giallo-uovo, l'arancio ed
il rosso mattone, lasciando a riposo la provetta per un po' di tempo il colore si depositerà sul fondo
sotto forma di un precipitato insolubile di composti di rame.

Per poter apprezzare meglio l'effetto è opportuno che il liquido su cui si effettua il test sia limpido,
nel caso di succo di frutta contenente particelle solide in sospensione è meglio effettuare la filtrazione
prima di effettuare la ricerca. Se si vuole evidenziare la presenza di zucchero (lattosio) nel latte è bene
aggiungere a 10 mL di latte tre o quattro gocce d'aceto per far precipitare le proteine, filtrare il tutto
ed utilizzare la soluzione limpida così ottenuta.
Nel caso la quantità di zuccheri presente nel campione fosse bassa il colore può diventare, invece che
giallo o rosso, di un verde torbido.
Scopo
Si parla di determinazione della quantità di zuccheri riducenti, ovvero in termini di reazioni di ossidoriduzione
solo quegli zuccheri che avendo un gruppo aldeidico (chetonico) libero sono in grado di ossidarsi (ad acido carbossilico)
secondo la reazione seguente:
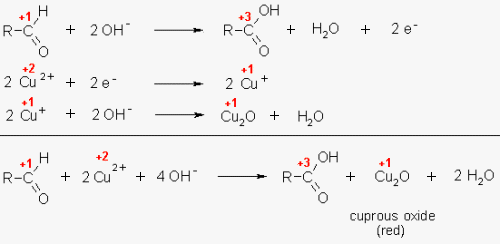
Il saccarosio quindi non è rilevato dal metodo di Fehling poiché è un disaccaride dove on sono presenti gruppi
organici aldeidici o chetonici liberi, non è quindi tal quale di ossidare lo ione rameico Cu++
presente nel reattivo di Fehling A.
Sostanze
Oltre alle comuni sostanze di acqua distillata, blu di metilene (soluzione acquosa all'1 %) bisogna avere
a disposizione o preparare i due reattivi:
Reattivo di Fehling A: in pallone tarato da 1000 mL si sciolgono 69,278 g di solfato rameico pentaidrato
(CuSO4 • 5 H2O questo è un sale di colore blu, facilmente reperibile in quanto
molto usato in agricoltura e giardinaggio) con acqua distillata o deionizzata e si porta a volume.
Reattivo di Fehling B: in pallone tarato da 1000 mL si sciolgono 346 g di sale di Seignette (tartrato
doppio di sodio e potassio, reperibile in farmacia) e 100 g di idrossido di sodio (NaOH) in acqua distillata
o deionizzata; a soluzione avvenuta si porta a volume.
Attrezzatura
Becco Bunsen o meglio piastra riscaldante
Beuta da 250 mL
Buretta da 50 mL
Cilindro graduato da 50 mL
Matraccio tarato da 100 mL
Palline di vetro (o pietra pomice)
Procedimento
Si prepara a parte un volume (soluzione eventualmente diluita) del campione da analizzare che deve essere esente
da torbidità. Generalmente si prendono 25 mL del campione e si diluiscono in un matraccio tarato a 100 mL.
In una beuta da 250 mL si pongono nell'ordine 5 mL di sluzione di Fehling A; 5 mL di soluzione di Fehling B
e 40 mL di acqua distillata. Si aggiungono inoltre 5-8 palline di vetro (o pietra pomice) per regolare l'ebollizione
così da evitare pericolosi schizzi nella parte successiva del procedimento.
Si porta all'ebollizione il contenuto della beuta e da una buretta graduata si fa scendere la soluzione in esame.
Si prosegue nell'aggiunta della soluzione zuccherina fino a che il liquido, possibilmente sempre in ebollizione
perda progressivamente il colore blu. Infatti l'ossido rameoso (di colore rosso) a mano a mano che si forma
precipita, e di conseguenza la soluzione sovrastante si decolora progressivamente. A questo punto, si aggiungono
due gocce di una soluzione di blu di metilene all'1%, e si fa bollire per un minuto. Trascorso questo tempo,
sempre mantenendo il liquido in ebollizione, si fa cadere goccia a goccia, altra soluzione zuccherina dalla buretta
fino a scomparsa della colorazione azzurra del blu di metilene. Infatti questo indicatore viene ridotto e decolorato
dagli zuccheri riducenti quando tutto il rame è precipitato.
Osservazioni
La prova è tanto migliore quanto più risulta rapida, l'uso del blu di metilene non è obbligatorio
ma è molto difficile distinguere il punto di fine titolazione solo utilizzando la colorazione azzurrina
del rame rameico.
Si consglia inoltre di utilizzare solo una goccia di blu di metilene per evitare di avere un eccesso
di colore blu, il viraggio dovrebbe essere sufficientemente chiaro per tutti gli occhi.
Si consiglia inoltre di utilizzare un cartoncino o un foglietto di carta così da coprire la beuta nel
corso della titolazione così da evitare che l'ossigeno dell'aria, entrando nel sistema, reagista nuovamente
con il blu di metilene ridotto (incolore) riossidandolo (alla forma blu) che come si intuisce crea un errore
casuale in eccesso sul valore reale della titolazione.
Terminata la titolazione l'ossigeno dell'aria se entra nel sistema lo ricolora a blu in base a quanto appena
descritto, quindi non preoccuparsi e rimanere tranquilli sul proprio risultato.
Il metodo risulta valido solo se la titolazione è rapida (3 minuti) e la concentrazione in zuccheri del
campione è compreso tra lo 0,5 e l'1%.
Calcoli
La stechiometria della reazione non è esatta per cui i calcoli derivano più dalla tecnica sperimentale
che dai calcoli teorici.
La formula da apllicarsi risulta la seguente:
g/L di monosaccaride (tipicamente glucosio) = 0,05154 • 1000 • diluizione / mL titolante
dove 0,05154 g esprime i grammi zuccheri ridotti da 5 mL di Fehling A.
In effetti a rigor di logica, 5 mL di Fehling A contengono 69,278 • 5 / 1000 = 0,34639 g di solfato
rameico pentaidrato (PM=249,6783) corrispondenti a 0.34639 / 249,6783 = 0.0013873 mol di Cu++.
Questi reagiscono teoricamente con 0,0013873 / 2 = 0,00069365 mol di monosaccaride.
Se consideraimo quale monosaccarde il glucosio (C6H12O6 PM=180,15894)
troviamo 0,00069365 • 180,15894 = 0,1249713 g di glucosio e non 0,05154 !
Se consderiamo che ogni monosaccaride si divida in due triosi durante la reazione quindi C6
H12O6 = 2 C3H6O3 (vedi oltre negli approfondimenti)
abbiamo allora la reazione seguente:
C3H6O3 + 2 Cu++ + 4 OH- —» C3H6O4 + Cu2O + 2 H2O
che porta come conseguenza il dimezzamento dei grammi di zucchero prima calcolati 0,1249713 / 2 =
0,0624857 g, valore già più vicino a quello sperimentale... di 0,05154.
Risultati
Nelle prove da noi condotte a scuola, con tutte le incertezze del caso, considerato che non si esegue
in maniera quantitativa ma spesso solo qualitativa, abbiamo trovato i seguenti risultati.
Soluzione di D-glucosio al 0,6% = 6 g/L
diluita di quattro volte
1° titolazione = 39 mL
titolo calcolato = 0,05154 • 1000 • 4 / 39 = 5,29 g/L
2° titolazione = 36 mL
titolo calcolato = 0,05154 • 1000 • 4 / 36 = 5,73 g/L
Soluzione di D-glucosio al 1,6% = 16 g/L
diluita di quattro volte
1° titolazione = 17,1 mL
titolo calcolato = 0,05154 • 1000 • 4 / 17,1 = 12,1 g/L
2° titolazione = 18,0 mL
titolo calcolato = 0,05154 • 1000 • 4 / 18,0 = 11,5 g/L
metodo gravimetrico
Dalle ultime DUE titolazioni abbiamo precipitato e successivamente isolato per filtrazione, come precedentemente
esplicitato nei calcoli, circa 0,0012873 mol di ossido rameoso (Cu2O PM 143,0794 pari a 0,20 g).
Corrispondenti secondo la procedura classica di Fehling a quindi 0,05154 • 2 = 0,10308 g di glucosio,
misura in difetto rispetto a quella prevista poiché svolgendo i calcoli si ha una quantità di glucosio nettamente
superiore:
(16 / 4) / 1000 • 35 = 0,14 g di glucosio !
Conclusioni
Il saggio di Fehling è corretto se svolto su vini e mosti, per cui le conclusioni che seguono valgono limitatamente
alle soluzioni acquose (pure) di D-glucosio.
(1) Abbiamo svolto il saggio di Fehling su due soluzioni di D-glucosio ottenendo dei dati sperimentali
adeguati o compatibili con la soluzione (dal titolo noto) che volevamo verificare, comunque l'imprecisione
dei dati sperimentali è abbastanza evidente ± 1 g/L !
(2) Nell'analisi gravimetrica dobbiamo invece considerare quale parametro di conversione non 0,05154 g ma un
numero maggiore vicino allo "stechiometrico" 0,0624857 g.
Considerando infatti di essere andati un po' oltre nelle DUE titolazioni (errore sistematico in eccesso)
a 35,1 mL (= 17,1 mL + 18,0 mL) della soluzione diluita allo 0,4% corrispondevano 140 mg di glucosio.
Approfondimenti
Il glucosio ovviamente risulta uno zucchero riducente, e reagisce infatti con il reattivo di Fehling
formando un precipitato arancio o rossiccio. IL reattivo di Fehling inversamente è in grado di reagire
con la maggior parte delle molecole che contengono gruppi aldeidici (R-CHO) in base alla reazione
esposta precedentemente. Il D-fruttosio non è un aldozucchero ma un chetozucchero che però in ambiente
basico è in grado di isomerizzarsi a D-glucosio e D-mannosio. La reazione di isomerizzazione può avvenire
tramite un intermedio enolico come illustrato dalle seguenti formule:
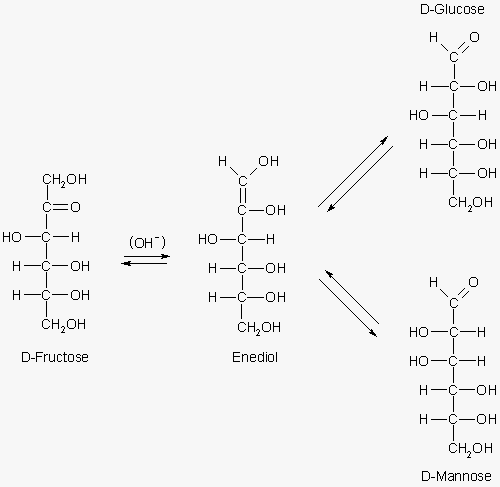
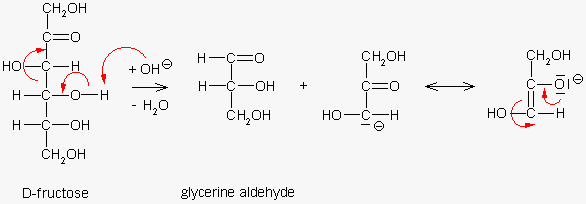
Un'altra ipotesi prevede invece che il D-fruttosio in mabiente alcalino possa scomporsi nei due composti
tricarboniosi D-gliceraldeide e diidrossiacetone, similmente a quanto avviene nella glicolisi. Entrambi
con la capacità di ridurre il rame Cu++.
Da sottolineare inoltre il fatto che il test di Fehling risulta selettivo poiché sfrutta le deboli capacità
ossidanti dei gruppi aldeidici in ambiente basico. Lo ione rameico non è normalemnte stabile in ambinete
basico poiché tende a precipitare come idrossido rameico:
Cu++ + 2 OH- —» Cu(OH)2
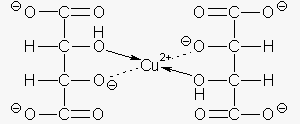
E qui sta la grande capacità di von Fehling che riuscì a pensare al tartrato quale agente complessante
(all'epoca si stava infatti scoprendo il grande campo dei composti complessi). Il D-tartrato non è in grado
di complessare lo ione rameoso Cu+ così che esso precipita come ossido (l'idrossido rameoso non
è infatti stabile). La struttura del D-tartrato rameico risulta esssere la seguente:
Per ulteriori informazioni consultare
tutti i testi di chimica generale e di chimica-fisica
http://en.wikipedia.org/wiki/Hermann_von_Fehling
http://it.wikipedia.org/wiki/Reattivo_di_Fehling
http://it.wikipedia.org/wiki/Hermann_von_Fehling
http://madscientist.altervista.org/chimica/esperimenti/riczucc/fehl.htm
|