DIMENSIONE DELLA MOLECOLA DI ACIDO OLEICO
Scopo
Scopo dell'esperienza è la determinazione dell'ordine di grandezza e di altezza
del diametro della molecola di acido oleico.
Prerequisiti
- conoscere le formule della geometria piana e solida;
- conoscere il numero di Avogadro 6,0221367*1023;
- conoscere la struttura della molecola di acido oleico;
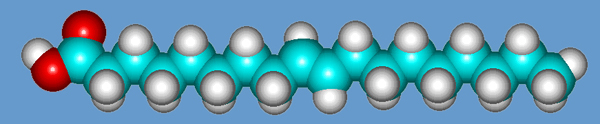
La molecola di acido oleico è una lunga molecola costituita da carbonio, idorgeno e ossigeno
di formula C18H34O2, PM 282,47 u.m.a., densità tra 0,873 e 0,9, e struttura:
HOOC-CH2-CH2-CH2-CH2-CH2-
CH2-CH2-CH=CH-CH2-CH2-CH2-CH2-
CH2-CH2-CH2-CH3
Su una superficie idrofilica le molecole si dispongono verticalmente una accanto all'altra (non
essendo a livello molecolare l'accelerazione di gravità influente sulla posizione delle molecole)
così da frapporsi con uno strato tra l'acqua e l'aria.
Materiali e strumenti.
In laboratorio saranno presenti:
- vaschetta di almeno 40 x 40 cm;
- buretta (o cilindro graduato da 10 ml);
- soluzione al 2‰ v/v di acido oleico in alcool etilico (o metilico o isopropilico);
- polvere di gesso o polvere di licopodio;
- acqua;
- righello di 20 cm.
Tempo
L'esperienza ha la durata di circa 40 minuti, 15 di esecuzione pratica e 25 di spiegazione
con calcoli relativi alle misure effettuate.
Procedimento
Coprire il fondo della vaschetta con acqua e cospargere la superficie con un po' di polvere
di licopodio; la polvere deve essere appena appena visibile.
Lasciarvi cadere una goccia di alcool, si constata che si forma sulla superficie dell'acqua una
chiazza che scompare rapidamente pouiché l'alcool sui dissolve (se non dovesse scomparire, ciò è
imputabile alla non purezza dell'alcool).
Lasciarvi quindi cadere una goccia di soluzione al 2 ‰ di acido oleico in alcool e misurare
il diametro medio della chiazza che si forma (chiazza dovuta all'acido oleico poiché l'alcool si
dissolve rapidamente). la chiazza libera da gesso o licopodio avrà il diametro di circa 12 cm.
Si consideri la chiazza di forma approssimativametne cilindrica per cui, dopo aver determinato il
volume dell'acido oleico contenuto nella goccia che ha formato la chiazza, si può applicare la
relazione h = V/πr2, dove h è lo spessore, V il volume ed r il raggio della chiazza di
acido oleico.
La misura di h consente di determinare almeno un limite superiore delle dimensioni della molecola
di acido oleico.
Calcoli e Risultati
Per calcolare il volume di una goccia adoperiamo la buretta, per un volume di 1 ml cadono 60 gocce
per cui una goccia ha un volume approssimativo di 0,0167 ml.
Poiché la soluzione di acido oleico è al 2 ‰ ne risulta con una semplice operazione che in
una goccia è precente una quantità di acido oleico pari a:
0,0167 * 2 / 1000 = 0,0000333 ml
Sapendo che la densità dell'acido oleico puro è 0,873 g/ml risulta che in una goccia è presente, in
peso, una quantità di acido oleico pari a:
0,0000333 * 0.873 = 0,0000290 g
E sapendo che una mole di acido oleico vale 282 g, la quantità trovata sopra corrisponde a:
0,0000290 / 282 * 6,0229*1023= 6,21*1016 molecole
La chiazza che si forma ha diametro di circa 12 cm da cui si calcola un'area circolare pari a:
π * r2 = 3,1416 * 36 = 113 cm2
e assumendo la chiazza cilindrica possiamo calcolare uno spessore di:
0,0000333 / 113 = 2,95*10-7 cm
Calcolo del valore di un legame C-C
Dalla formula chimica e dalla ipotesi della disposizioen verticale di ogni molecola possiamo
calcolare che sulla "verticale" saranno presenti circa 17 legami C-C, un legame C-O e un legame
C-H per un totale di 19 legami.
Dividendo quindi lo spessore trovato per 19 otteniamo come valore per un legame singolo il valore di
2,95 *10-7 / 19 = 1,55 * 10-7 cm = 1,55 * 10-9 m
1,55 * 10-9 m = 15,5 * 10-10 m = 15,5 Å
Da confrontare con il valore ottenuto da tecniche cristallografiche che risulta circa 1,5
Å
e malgrado il valore ottenuto sia 10 volte più grande, possiamo considerare il risultato
soddisfacente nei limiti sperimentali con cui stiamo operando.
Calcolo del numero di Avogadro
Per calcolare lo spessore della chiazza di acido oleico non abbiamo fatto uso del
numero di Avogadro che inversamente si può invece calcolare assumento che ogni
molecola di acido oleico abbia una forma sferica e si disponga su uno strato solo
sopra l'acqua.
Se la molecola avesse forma sferica lo spessore calcolato corrisponde anche al
diametro della sferetta che ha formula V = 4/3 π*r3.
Per una mole possiamo quindi calcolare un volume complessivo di:
V di una mole di acido oleico = 282 / 0,873 = 323 ml
Per calcolare il numero di molecole contenute in una mole basta quindi dividere
il volume di una mole per il volume di una molecola. Sia 12 cm il diametro medio
della macchia di acido oleico e quindi 6 cm il suo raggio. Da quanto scritto si ha
quale raggio di una molecola 2,95*10-7 /2 = 1,47*10-7 cm.
Pertanto il volume di una molecola corrisponderebbe a:
V di una molecola di acido oleico = 4/3 * π * (1,47*10-7)3 =
1,33*10-20cm3 = 1,33*10-20 ml
Concludendo si calcola come numero di Avogadro la seguente approssimazione:
NA = 323 / 1,33*10-20 = 2,43 * 1022 molecole
2° ESPERINEZA Calcoli base
In una seconda esperienza si è stimato il volume di una goccia di soluzione al 2 ‰
acido oleico in alccol pari a (2ml:114 gocce) 0,0175 ml ed ha formato una chiazza grande
in diametro circa = 11,5 cm da cui segue un'area circolare di
Sapendo che la densità dell'acido oleico puro è 0,873 g/ml risulta che in una goccia è
presente, in peso, una quantità di acido oleico pari a:
0,0000175 ml o 0,873 g/ml = 0,0000153 g
E sapendo che una mole di acido oleico vale 282 g, la quantità trovata sopra corrisponde
a:
0,0000153 / 282 * 6,0229o1023= 3,27*1016 molecole
La chiazza che si forma ha diametro di circa = 11,5 cm da cui si calcola un'area circolare pari a:
π * r2 = 103,87 cm2
e assumendo la chiazza cilindrica possiamo calcolare uno spessore di:
0,0000175 ml / 103,87 cm2 = 1,68*10-7 cm = 1,68*10-9 m = 16,8 Å
Il che corrisponde ad una lunghezza del legame C-C di circa
1,68*10-9 m : 19 = 8,8*10-11 m = 0,88 Å
Da confrontare con il valore ottenuto da tecniche cristallografiche che risulta circa 1,5 Å.
Calcolo del numero di Avogadro
Se la molecola avesse forma sferica lo spessore calcolato corrisponde anche al diametro della
sferetta che ha formula V = 4/3 π*r3.
Per una mole possiamo quindi calcolare un volume complessivo di:
V di una mole di acido oleico = 282 / 0,873 = 323 ml
Per calcolare il numero di molecole contenute in una mole basta quindi dividere il volume di una
mole per il volume di una molecola. Sia 11,5 cm il diametro medio della macchia di acido oleico
e quindi 5,75 cm il suo raggio. Da quanto scritto si ha quale raggio di una molecola
1,68*10-7 / 2 = 0,84*10-7 cm.
Pertanto il volume di una molecola corrisponderebbe a:
V di una molecola di acido oleico = 4/3 * π * (0,84*10-7)3 = 2,48*10-21 cm3
Concludendo si calcola come numero di Avogadro la seguente approssimazione:
NA = 323 / 2,48*10-21 = 1,30 * 1023 molecole
Se si assume le molecole si dispongano verticalmente a mo' di cilindretti possiamo calcolare un volume teorico per ogni singola molecola come segue:
1° esperienza (1°G) 0,0000333 ml / 113 cm2 = 2,95*10-7 cm
2° esperienza (1°H) 0,0000175 ml / 103,87 cm2 = 1,68*10-7 cm
media dei due valori spessore = 2,3*10-7 cm
assumendo idealmente il cilindretto avente raggio di base 10 volte più piccolo della lunghezza calcoliamo un volume di:
base π*(0,23*10-7 cm)2 = 1,66*10-15 cm2
altezza 2,3*10-7 cm
volume base * altezza = 1,66*10-15 cm2 * 2,3*10-7 cm = 3,82*10-22 cm3 = 3,82*10-22 ml
NA = 323 / 3,82*10-22 = 8,45*1023 molecole
Ringraziamenti
Si ringraziano della collaborazione le classi 1°G e 1°H dell'ITCG "G. Compagnoni" di Lugo.
|