ALCUNE REAZIONI CARATTERISTICHE E LA LEGGE DI CONSERVAZIONE DELLA SIMMETRIA
Nella lezione precedente si è fatto riferimento al gruppo di non-reazioni:
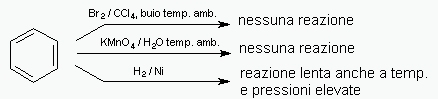
usate quale presupposto per dimostrare la stabilità delle molecole aromatiche che le avvicina ai composti saturi.
Infatti se dividiamo i composti della chimica organica in saturi (presenti solo legami semplici C-C) e insaturi (presenti legami doppi o tripli) dobbiamo a questo punto dividere tra molecole insature di sola natura aromatica e altre molecole insature; sono proprie di quest’ultimo gruppo le reazioni rappresentate sopra del reagente con 1) idrogeno, 2) bromo, 3) permanganato di potassio.
1) Consideriamo quale reagente la molecola insatura più semplice, ovverosia l’etene o etilene che risulta una piccola molecola planare composta da 6 atomi e con formula bruta C2H4. La sua reazione con l’idrogeno porta alla saturazione della molecola ed ogni doppio legame C=C si rompe per formare due legami semplici C-H.
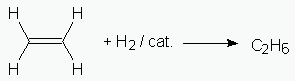 Partiamo da una molecola altamente simmetrica con 3 P, C, 3 A2 ed arriviamo ad un’altra molecola altamente simmetrica.
Partiamo da una molecola altamente simmetrica con 3 P, C, 3 A2 ed arriviamo ad un’altra molecola altamente simmetrica.
Poiché i legami C-H sono insieme ai legami C-C i più comuni della chimica organica questa reazione non risulta particolarmente complicata nella determinazione dei prodotti.
2) Molte delle cose dette per la reazione con l’idrogeno sono valide anche per la reazione con il bromo, con la differenza che per ogni doppio legame C=C che reagisce si formano due legami semplici C-Br.
Se la quantità di bromo è deficitaria rispetto a quella dell’idrocarburo insaturo durante la reazione si può osservare una decolorazione della soluzione organica da rosso intenso (colore del bromo) a incolore; infatti le molecole della chimica organica contenenti solo legami semplici non sono in genere colorate.
Senza soffermarci sul meccanismo della reazione, in alcuni casi ancora incerto, vediamo di sviluppare il caso della reazione di un substrato relativamente semplice quale il propene con la molecola del bromo.
Il propene è una molecola simmetrica con 1 P di simmetria, in questo caso non si ha un solo prodotto ma due prodotti ed esattamente una coppia di enantiomeri prodotti in quantità eguale (miscela racemica). La simmetria del reagente viene quindi “conservata” attraverso la produzione di due prodotti uguali (per proprietà chimiche) ma opposti (essendo uno l’immagine speculare dell’altro).

Substrati asimmetrici danno ovviamente coppie di prodotti con conservazione dell’asimmetria.
3) La reazione con permanganato (forte ossidante) in ambiente acquoso spesso non da un solo prodotto ma una miscela di prodotti con la presenza di legami semplici C-O o legami doppi C=O anche qui con conservazione della simmetria (prodotti simmetrici + miscele racemiche)
Bibliografia
S. Passananti, S. Ponente, C. Sbriziolo “Principi di chimica” Tramontana 2000
T.W. Graham Solomons "Chimica organica" 1988
|