L’AROMATICITÀ e la regola di Hückel
A seguito della scoperta del benzene e delle sue insolite proprietà di stabilità in presenza di alogeni, ossidanti
e acidi:
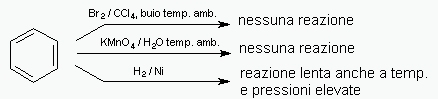
nel 1931 il fisico E. Hückel sviluppò una serie di calcoli matematici su molecole costituite essenzialmente da anelli
monociclici piani, in cui ciascun atomo dell’anello disponeva di un orbitale p perpendicolare al suddetto piano (come
avviene nel benzene).
Questi calcoli mostrarono che
le strutture cicliche piane contenenti
4n + 2 elettroni di tipo p (legami di tipo π) con n = 0, 1, 2, 3, 4, 5 ...
hanno energie di risonanza o di delocalizzazione non trascurabili. In altre parole gli anelli monociclici piani con 2,
6, 10, 14, 18, 22 ... elettroni in orbitali di tipo π (leggi 'pi greco') delocalizzati intorno all’anello sono
aromatici.
La strutture mostrate di seguito risultano molto stabili nei confronti dei loro isomeri, gli scienziati gli hanno quindi
attribuito le caratteristiche di aromaticità.
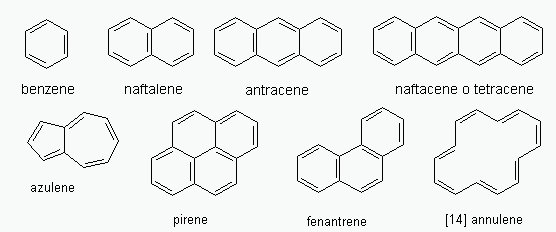
A questa categoria dobbiamo aggiungere poi tutte le molecole aventi struttura ciclica che perdendo o acquisendo
elettroni riescono a raggiungere un numero "magico" della serie 4n + 2, alcuni esempi sono i seguenti:

Vi sono molecole aromatiche il cui anello è formato oltreché da atomi di carbonio anche da uno o più atomi di elementi
diversi dal carbonio. Questi composti si dicono composti aromatici eterociclici. La struttura elettronica di queste
molecole è simile a quella dei composti aromatici di tipo benzenico. I più comuni composti eterociclici sono quelli
che contengono come eteroatomi azoto ossigeno e zolfo.
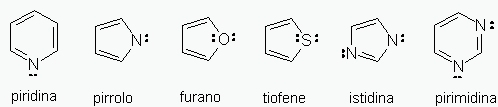
Come capire se i doppietti elettronici sono elettroni di tipo p? In via pratica si verifica che se l’eteroatomo (per esempio)
N è legato a due altri atomi con legame singolo, il suo doppietto (o uno solo dei doppietti elettronici, per O e S)
parteciperà nel numero degli elettroni p, se invece è legato a due altri atomi con un legame doppio il suo dppietto
non parteciperà nel numero degli elettroni p. Questi sono gli eterocicli aromatici più comuni.
Bibliografia
S. Passananti, S. Ponente, C. Sbriziolo "Principi di chimica" ed. Tramontana, 2000
T.W. Graham Solomons "Chimica organica" 1988
|