METALLI E NON-METALLI PERCHE'
Spiegazione in funzione degli orbitali di valenza s e p
introduzione
È logico chiedersi perché gli atomi a del gruppo IA e del gruppo VIIA all'altra estremità
della tavola periodica si comportano in maniera diversa?
Una possibile interpretazione si collega alla teoria degli orbitali atomici. Si sa per certo che
nell'atomo di idrogeno l'elettrone esterno non è libero di muoversi dove vuole ma, attirato dalla
carica positiva del nucleo, risulta costretto a stare in zone dello spazio che per la loro affinità
al comportamento dei pianeti che ruotano attorno al sole (i quali girano lungo orbite) sono state
chiamate orbitali.
Nel corso del tempo alcuni fenomeni magnetici ceh sorgevano quando si analizzavano gli atomi sotto
l'azione di forti campi magnetici furono risolti brillantemente dai fisici introducendo un certo
numero di numeri quantici:
- primo (indicato con n) ad indicare la distanza dal nucleo
- secondo (indicato con l) ad indicare la forma dell'orbitale
- terzo (indicato con ml) ad indicare la direzione dell'orbitale
- quarto (indicato con ms) come un moto di spin proprio dell'elettrone.
Vedi per una trattazione più esauriente quanto scritto alla pagina degli orbitali.
Come si studia nel primo anno di chimica il comportamento degli atomi è determinato dall'ultimo
o dagli ultimi livelli di questi orbitali ossia dalla maniera con cui la carica elettrostatica del nucleo
viene "schermata" o "rinchiusa" dagli elettroni che gli girano intorno.
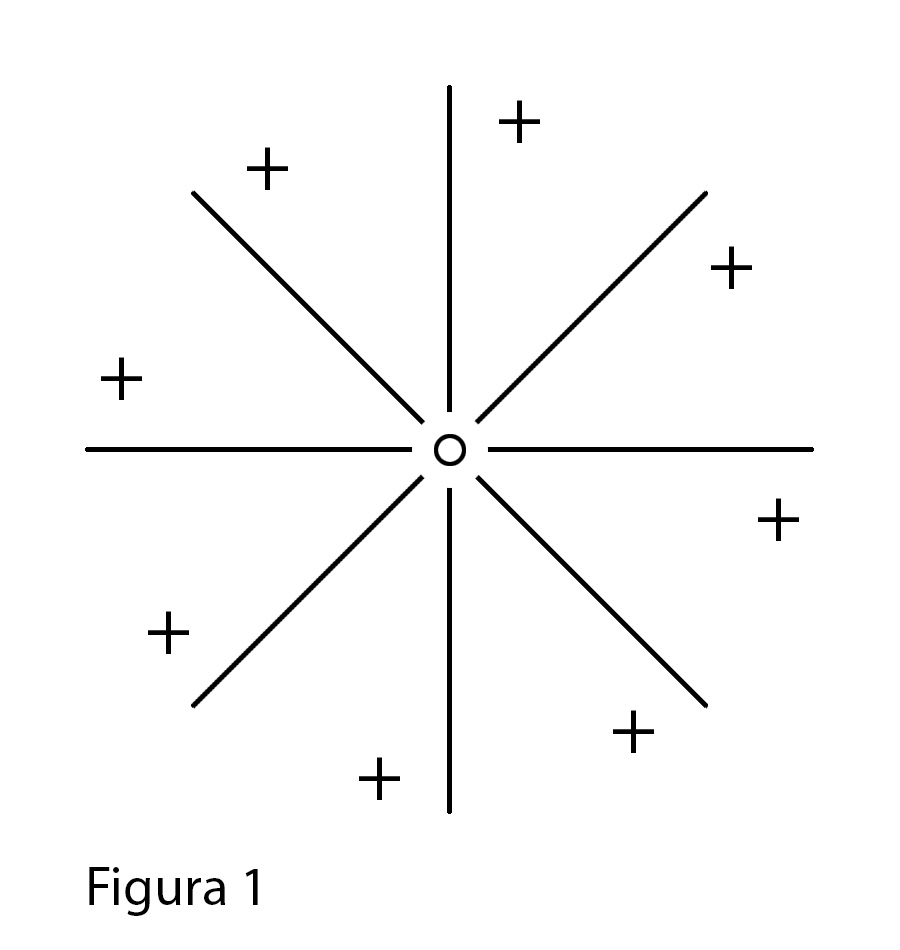 In assenza di elettroni, il nucleo dell'atomo con carica positiva genera un campo che si estende
indefinitamente secondo le regole dei campi calcolabili dalla fisica classica (campo elettrostatico
positivo in questo caso) come da figura 1.
In assenza di elettroni, il nucleo dell'atomo con carica positiva genera un campo che si estende
indefinitamente secondo le regole dei campi calcolabili dalla fisica classica (campo elettrostatico
positivo in questo caso) come da figura 1.
Nei metalli dei gruppi IA e IIA l'ultimo livello occupato dagli elettroni è un orbitale di tipo s;
esempi: sodio n°11 ultimo orbitale 3s1; calcio n° 20 ultimo orbitale occupato 4s2;
bario n° 56 ultimo orbitale 6s2.
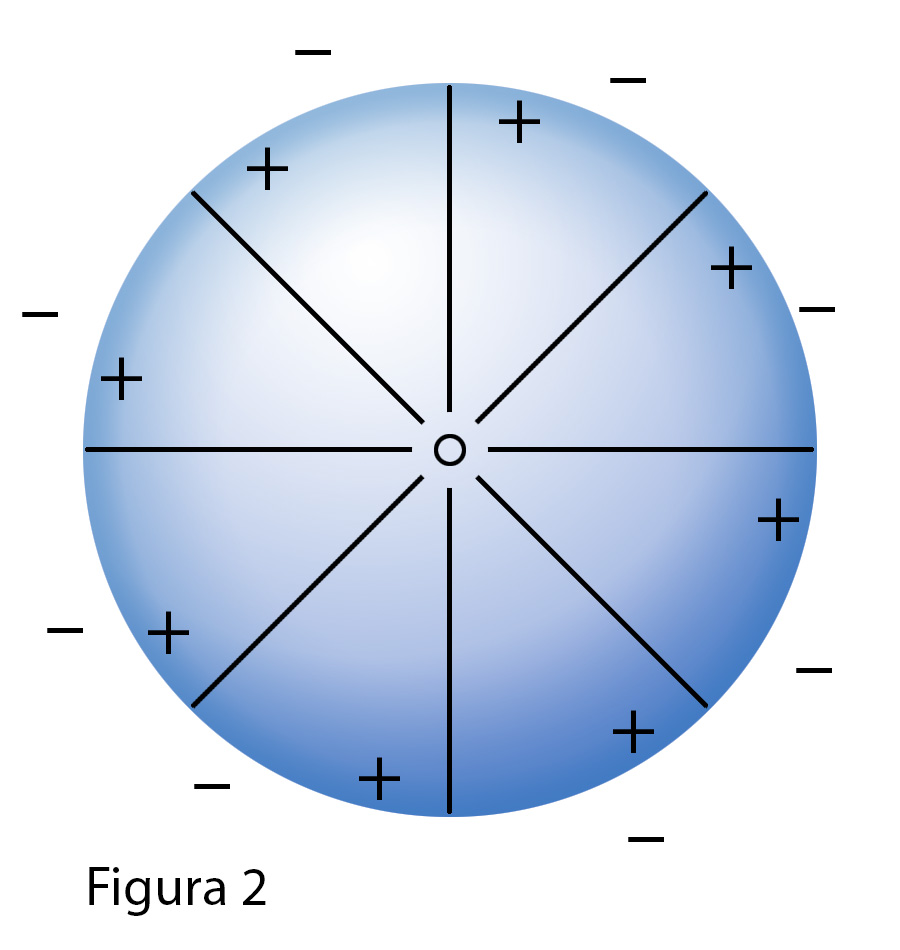 L'obitale s è di forma simmetrica e l'elettrone occupandolo compensa completamente e in tutte le
direzioni il campo elettrostatico positivo generato dal nucleo comein figura 2, girando ad una
velocità che per l'atomo di idrogeno si stima attorno a 2180000 m/s = 2180 km/s, più
bassa della velocità della luce ma pur sempre notevole (anche se io stimo che tale velocità
sia una approssimazione in forte difetto).
L'obitale s è di forma simmetrica e l'elettrone occupandolo compensa completamente e in tutte le
direzioni il campo elettrostatico positivo generato dal nucleo comein figura 2, girando ad una
velocità che per l'atomo di idrogeno si stima attorno a 2180000 m/s = 2180 km/s, più
bassa della velocità della luce ma pur sempre notevole (anche se io stimo che tale velocità
sia una approssimazione in forte difetto).
Negli elementi di transizione o metalli dei gruppi B dal IIIB passando dall'VIIIB fino al IIB, l' orbitale
più esterno rimane un orbitale di tipo s ma spostandosi verso destra si riempiono di elettroni
degli orbitali di tipo d di livello energetico inferiore, e che talvolta vengono indicati come "orbitali
interni";
esempi: cromo n°24 ultimi orbitali 3d54s1; rutenio n° 44 ultimi orbitali occupati
4d85s1; platino n° 78 ultimi orbitali 5d96s1.
Significa che allo stato neutro (puri) essi si comportano come metalli ma se perdono gli elettroni
negli orbitali s (uno o due a seconda degli elementi) espongono gli orbitali di tipo d che si comportano
nello schermare la carica nuclera in maniera intermedia tra come operato dall'orbitale s (schermatura simmetrica)
e come operato dagli orbitali p (schermatura non simmetrica).
Nei non-metalli dei gruppi dal IIIA al VIIA gli orbitali più esterni risultano gli orbitali p;
esempi: boro n°5 ultimo orbitale 2p1; antimonio n° 51 ultimo orbitale occupati 5p3;
polonio n° 84 ultimo orbitale 6p4.
Qual è la caratteristica di questi orbitali nei riguardi della carica del nucleo?
Prendiamo per semplicità un solo orbitale p illustrato in figura 3).
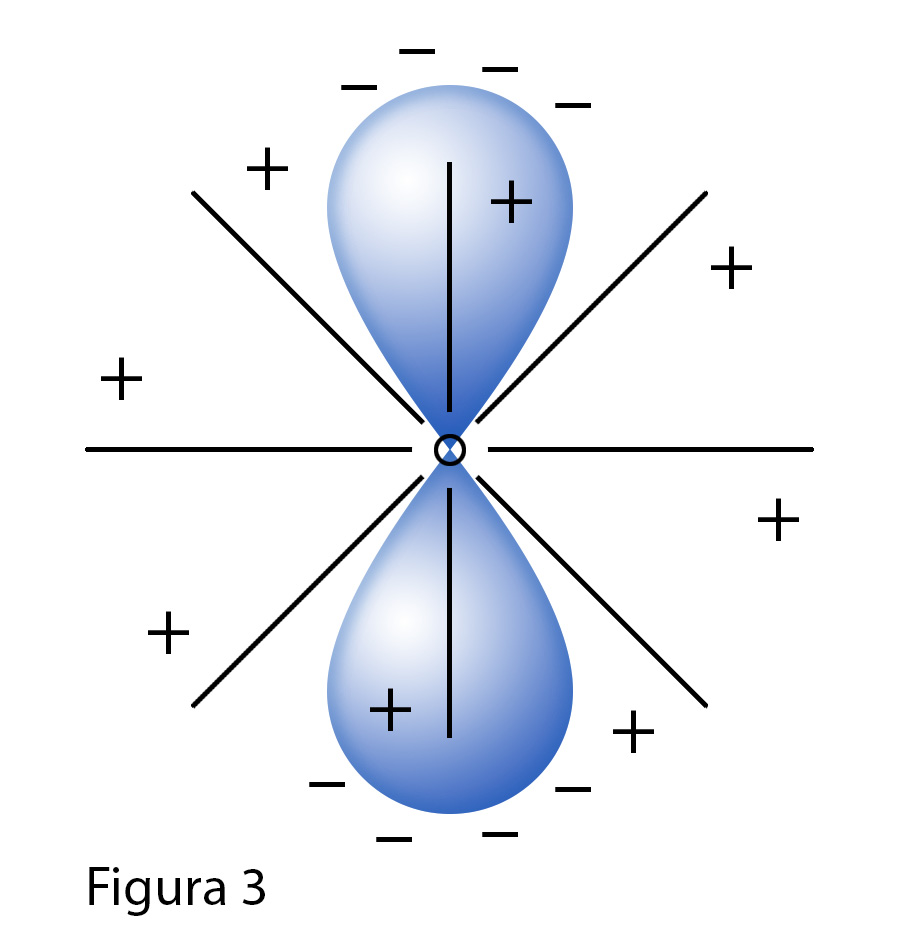 Come si nota l'elettrone non gira in maniera simmetrica attrono al nucleo e non riesce a schermare
la carica positiva del nucleo in maniera opportuna lo spazio si osserva quindi che l'atomo
rimpicciolisce di volume e lo spazio attorno si divide in una zona con un campo elettrostatico
negativo e in una zona dove si sente il campo elettrostatico positivo del nucleo.
Come si nota l'elettrone non gira in maniera simmetrica attrono al nucleo e non riesce a schermare
la carica positiva del nucleo in maniera opportuna lo spazio si osserva quindi che l'atomo
rimpicciolisce di volume e lo spazio attorno si divide in una zona con un campo elettrostatico
negativo e in una zona dove si sente il campo elettrostatico positivo del nucleo.
Con un tale tipo di orbitali esterni (si usa il plurale poiché esistono tre ortogonali orbitali p uno
per ogni direzione dello spazio x, y e z) si osservano atomi che hanno la forte tendenza a prendere
ulteriori elettroni (alta affinità elettronica) trasformandosi così in anioni, per schermare la carica
positiva che risulta in alcune direzioni dello spazio.
Sui libri questo fatto viene indicato come "raggiungimento dell'ottetto", ossia il non metallo
acquista elettroni fino al raggiungimento del numero di otto elettroni nel livello elettronico
più esterno, per raggiungere la configurazione del gas nobile più vicino che è
del tipo s2p6 (indicato anche come n s2 n p6
con n numero dell'ultimo livello energetico occupato dagli elettroni), che avendo una disposizione
finalmente simmetrica di elettroni che schermano la carica positiva del nucleo (p6) risulta
più stabile rispetto alla situazione originaria di "non ottetto".
regola dell'ottetto e legame ionico
Mettendo vicino quindi un atomo neutro di tipo metallico ed un atomo neutro di tipo non-metallico,
si osserverà il trasferimento di uno o più elettroni dal metallo al non-metallo, poiché
quest'ultimo tende a "strappare" elettroni da tutti gli atomi che possono cederglieli; particolarmente
reattivi sono quindi ossigeno atomico O, fluoro atomico F, e cloro atomico Cl che sono quindi estremamente
pericolosi, come pure, su un livello inferiore, lo sono le molecole di ossigeno O2, fluoro
F2 e cloro Cl2.
Un legame tra metallo e non-metallo viene indicato come legame ionico perché genera due o più
atomi/particelle con carica elettrica opposta.
Bibliografia
S. Passananti, S. Ponente, C. Sbriziolo “Principi di chimica” Tramontana 2000
Adolfo Ferrari "Trattato di chimica generale ed inorganica" 1965
|
 In assenza di elettroni, il nucleo dell'atomo con carica positiva genera un campo che si estende
indefinitamente secondo le regole dei campi calcolabili dalla fisica classica (campo elettrostatico
positivo in questo caso) come da figura 1.
In assenza di elettroni, il nucleo dell'atomo con carica positiva genera un campo che si estende
indefinitamente secondo le regole dei campi calcolabili dalla fisica classica (campo elettrostatico
positivo in questo caso) come da figura 1.
 L'obitale s è di forma simmetrica e l'elettrone occupandolo compensa completamente e in tutte le
direzioni il campo elettrostatico positivo generato dal nucleo comein figura 2, girando ad una
velocità che per l'atomo di idrogeno si stima attorno a 2180000 m/s = 2180 km/s, più
bassa della velocità della luce ma pur sempre notevole (anche se io stimo che tale velocità
sia una approssimazione in forte difetto).
L'obitale s è di forma simmetrica e l'elettrone occupandolo compensa completamente e in tutte le
direzioni il campo elettrostatico positivo generato dal nucleo comein figura 2, girando ad una
velocità che per l'atomo di idrogeno si stima attorno a 2180000 m/s = 2180 km/s, più
bassa della velocità della luce ma pur sempre notevole (anche se io stimo che tale velocità
sia una approssimazione in forte difetto). Come si nota l'elettrone non gira in maniera simmetrica attrono al nucleo e non riesce a schermare
la carica positiva del nucleo in maniera opportuna lo spazio si osserva quindi che l'atomo
rimpicciolisce di volume e lo spazio attorno si divide in una zona con un campo elettrostatico
negativo e in una zona dove si sente il campo elettrostatico positivo del nucleo.
Come si nota l'elettrone non gira in maniera simmetrica attrono al nucleo e non riesce a schermare
la carica positiva del nucleo in maniera opportuna lo spazio si osserva quindi che l'atomo
rimpicciolisce di volume e lo spazio attorno si divide in una zona con un campo elettrostatico
negativo e in una zona dove si sente il campo elettrostatico positivo del nucleo.
