Orbitali elettronici
introduzione
Oramai tutti sanno che gli elettroni si muovono attorno al nucleo di un atomo, e a una grande distanza
da questo, cosicché l'atomo, così come lo conosciamo è essenzialmente vuoto! Questo modello si chiama
atomo di Rutherford, successivamente Bohr ha studiato le possibili orbite (o per meglio dire orbitali)
del modello di atomo in questione trovando che gli esettroni si muovono su orbite che possiamo conoscere
fino ad un livello piuttosto accurato.
La teoria è tutta matematica e se ne definiscono gli elementi principali nella tabella seguente:
livello energetico
principale
1° numero quantico
(n) |
forma dell'obitale
(n° di nodi)
2° numero quantico
(l) |
orientazione nello spazio
3° numero quantico
(ml) |
rotazione di ogni
singolo elettrone
4° numero quantico
(ms) |
numero massimo
di elettroni
che riempiono
gli orbitali |
NOME dell'orbitale
o del gruppo di orbitali |
relativa energia |
| numero n | 0, 1, ... n-1 | -l, ... -2, -1, 0, 1, ... l | sempre
+½ , -½ | | | |
| 1 | 0 | 0 | +½ , -½ | 2 elettroni | 1s (1 orbitale) | 0 più bassa |
| 2 | 0
1 | 0
-1, 0, 1 | +½ , -½
, -½ | 2 elettroni
6 elettroni | 2s (1 orbitale)
2p (3 orbitali *) | 1
2 |
| 3 | 0
1
2 | 0
-1, 0, 1
-2, -1, 0, 1, 2 | +½ , -½
+½ , -½
+½ , -½ | 2 elettroni
6 elettroni
10 elettroni | 3s (1 orbitale)
3p (3 orbitali *)
3d (5 orbitali °) | 3
4
6 |
| 4 | 0
1
2
3 | 0
-1, 0, 1
-2, -1, 0, 1, 2
-3, ... 3 | +½ , -½
+½ , -½
+½ , -½
+½ , -½ | 2 elettroni
6 elettroni
10 elettroni
14 elettroni | 4s (1 orbitale)
4p (3 orbitali *)
4d (5 orbitali °)
4f (7 orbitali) | 5
7
9
12-13 |
| 5 | 0
1
2
3
4 | 0
-1, 0, 1
-2, -1, 0, 1, 2
-3, ... , 3
-4, ... , 4 | +½ , -½
+½ , -½
+½ , -½
+½ , -½
... | 2 elettroni
6 elettroni
10 elettroni
14 elettroni
... | 5s (1 orbitale)
5p (3 orbitali *)
5d (5 orbitali °)
5f (7 orbitali)
5g | 8
10
12-13
16-17
... alta |
| 6 | 0
1
2
3
4
5 | 0
-1, 0, 1
-2, -1, 0, 1, 2
-3, ... , 3
-4, ... , 4
-5, ... , 5 | +½ , -½
+½ , -½
+½ , -½
...
...
... | 2 elettroni
6 elettroni
10 elettroni
...
...
... | 6s (1 orbitale)
6p (3 orbitali *)
6d (5 orbitali °)
6f
6g
6h
| 11
14
16-17
... alta
... alta
... alta |
| 7 | 0
1
2
3
4
5
6 | 0
-1, 0, 1
-2, -1, 0, 1, 2
-3, ... , 3
-4, ... , 4
-5, ... , 5
-6, ... , 6 | +½ , -½
+½ , -½
...
...
...
...
... | 2 elettroni
6 elettroni
...
...
...
...
... | 7s (1 orbitale)
7p (3 orbitali *)
7d
7f
7g
7h
7i | 15
18
... alta
... alta
... alta
... alta
... alta |
* 3 orbitali di tipo p prendono il nome di => n px, n py, n pz
° 5 orbitali di tipo d prendono il nome di => n dxy, n dxz, n dyz, n dx2-y2, dz2.
In termini grafici possiamo rappresentare gli orbitali in base a l,ml come segue:
orbitale vista dall'altro
orbitale vista dal fianco | 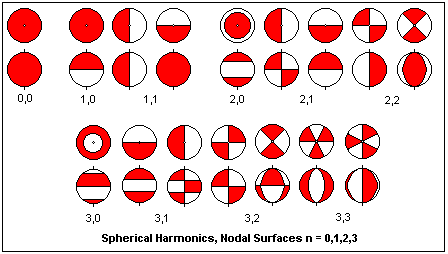 | orbitali rotanti
0,0
1,0 e 1,1
2,0 e 2,1 e 2,2
3,0 e 3,1 e 3,2 e 3,3
e inoltre
4,0 e 4,1 e 4,2 e 4,3 e 4,4
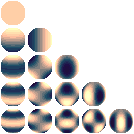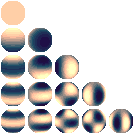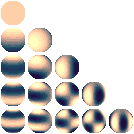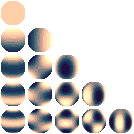 |
orbitale vista dall'altro
orbitale vista dal fianco
|
Bibliografia
AA.VV. Enciclopedia di Sicenza e Tecnica ed. Curcio 1976
Adolfo Ferrari "Trattato di chimica generale ed inorganica" ed. Riccardo Pàtron, Bologna 1965
G. Valitutti, A. Tifi, A. Gentile "La chimica in moduli" ed. Zanichelli
|