TEORIA DEGLI ORBITALI MOLECOLARI (3) ORBITALI DI FRONTIERA
introduzione
Gli orbitali di frontiera sono gli orbitali a più alta energia, sia pieni che vuoti, maggiormente
esposti all'interazione con altri elettroni o altri orbitali vuoti secondo la teoria della interazione
pieno-vuoto.
Al di là delle due dottrine: teoria degli orbitali ibridi o combinazione lineare di orbitali atomici,
il modello degli orbitali di frontiera si applica bene in entrambi i casi.
Questo perché entrambe le teorie prevedono essere:
1) gli orbitali atomici di tipo p gli orbitali ad interagire con combinazioni lineari per formare orbitali
di frontiera indicati con gli acronimi Homo e Lumo; oppure
2) gli orbitali atomici di non legame ossia doppietti elettronici nei loro rispettivi orbitali atomici
che nella dottrina degli O.M. non si possono combinare per motivi di simmetria con altri orbitali atomici
a formare spesso gli orbitali Homo nel caso dei nucleofili.
Gli acronimi Homo e Lumo stanno ad indicare:
- HOMO orbitale occupato a più alta energia (in inglese Highest Occupied molecular orbital);
- LUMO orbitale non occupato a più bassa energia (in inglese Lowest Unoccupied molecular orbital);
Nella teroia degli orbitali ibridi nel caso 2) ossia gli orbitali atomici di non legame, non interviene
la parola Homo ma si preferisce indicarli semplicemente con la lettera latina n (per non legame).
In molti studi intervengono non solo i duie orbitali di frontiera appena indicati, ma anche gli orbitali vicini:
- S-HOMO penultimo orbitale occupato a più alta energia (in inglese Second Highest Occupied molecular orbital);
- S-LUMO secondo orbitale non occupato a più bassa energia (in inglese Second Lowest Unoccupied molecular orbital).
interazione pieno-vuoto
Nell'ambito della reattività chimica, sopratutto in chimica organica, sono quindi gli orbitali
atomici o molecolari Homo e Lumo (tra i due reagenti o tra le diverse parti di una stessa molecola) ad
interagire tra di loro come primo passaggio dell'evoluzione di una reazione chimica.
HomoReagente1 + LumoReagente1 —» [Stato di transizione] —» prodotti
LumoReagente1 + HomoReagente2 —» [Stato di transizione] —» prodotti
In altri termini una interazione tra un orbitale pieno ed uno vuoto, per cui va sotto il nome comune
di "interazione pieno-vuoto".
Senza addentrarci ulteriormente in questo vasto campo della chimica semiempirica, utile è
l'analisi degli orbitali di frontiera delle molecole organiche più note che si possono facilmente
determinare, in via qualitativa, solo in base a semplici elementi di simmetria:
- un orbitale (sia atomico che molecolare) ha tanta più energia quanto maggiore è il numero di
nodi (piani dove la finzione si annulla) che dividono l'orbitale.
benzene
Il benzene, dalla formula bruta di C6H6, fu scoperto da vari chimici che lo
ottennero da varie fonte naturali. Essi notarono subito l’alto grado di insaturazione presente nella
molecola e perciò provarono ad applicare su questa molecola le reazioni tipiche atte a determinare
la struttura degli alcheni.
La solfonazione, la bromurazione con bromo (Br2), l’attacco con permanganato di potassio non
riuscivano però ad intaccare facilmente questa nuova molecola.
Quando questa reagisce con acido solforico (H2SO4) o con bromo (Br2)
in presena di tribromuro di ferro (FeBr3), fornisce reazioni di sostituzione ma non di addizione.
Questa molecola è ora capostipite di una nuova classe di sostanze organiche dette aromatiche
che esibiscono una struttura ed un comportamento chimico del tutto particolare. In breve qui
riassiumiano i dati strutturali fin qui proposti:
1) la struttura è quella di un esagono regolare con lunghezze di legame, comune ad ogni legame C-C,
pari a 1,39 Å, più corti di quello di un ipotetico cicloesatriene che dovrebbe avere tre legami
semplici, da1,54 Å, e tre legami doppi da 1,33 Å.
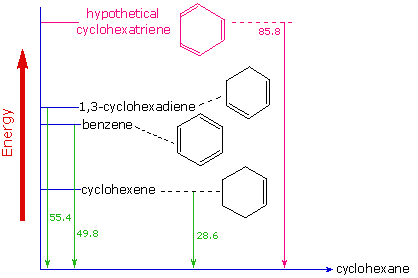
2) Presenta un calore di Idrogenazione quando forma il cicloesano di -49,8 kcal/mole, mentre quello
teorico del cicloesatriene – 85,8 kcal/mole. Si ha quindi una maggiore stabilizzazione di circa 36 kcal/mole
che rende un po’ conto della più difficile reattività del benzene rispetto ad un alchene.
In un primo tempo fu proposto il concetto di risonanza, mentre ora il comportamento chimico fisico
del benzene è spiegato attraverso la sua struttura orbitalica tutta particolare:
La descrizione del Benzene attraverso la teoria degli orbitali molecolari fornisce una spiegazione
più soddisfacente ed un trattamento più generale della aromaticità.
La sua struttura esagonale planare è spiegata nella teoria degli orbitali ibridi mediante
l’ibridzazione sp2 a formare legami σ tra gli atomi di carbonio con sei atomi di idrogeno.
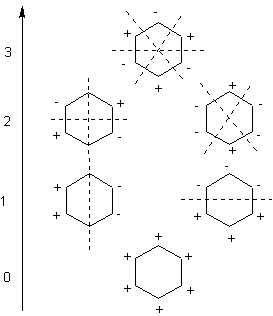
I sei orbitali p che insistono sui sei atomi di carbonio si combinano a formare sei orbitali molecolari π:
tre ad energia minore chiamati di legame π1, π2 e π3,
e tre ad energia maggiore degli orbitali p originari detti di anti legame: π4*,
π5* e π6*.
Il colore che si trova sul grafico rappresenta il segno della fase dell’orbitale, non la carica elettrica.
 |
 |
| combinazione lineare (fasi) degli orbitali atomici di tipo p combinati per formare i diversi
tipi di orbitali π. I numeri 0, 1, 2, 3 indicano il numero di piani dove la funzione si annulla. |
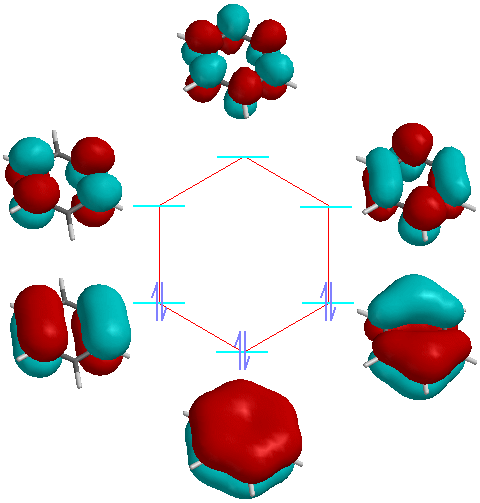
visualizzazione grafica dello schema precedente; si può notare come il grafico rispetti la
forma esagonale della molecola, questa analogia è applicabile solo in alcuni casi. |
Dato che il numero di elettroni totali &pi: sono sei, risultano occupati i tre orbitali π di legame,
formando così un guscio completo che dà al benzene quella stabilità termodinamica
e chimica, al pari di come un ottetto completo conferisce la stabilità al gas nobile.
In definitiva la densità elettronica sulla molecola del benzene, così come calcolata dai moderni elaboratori
prevede la seguente densità elettronica:
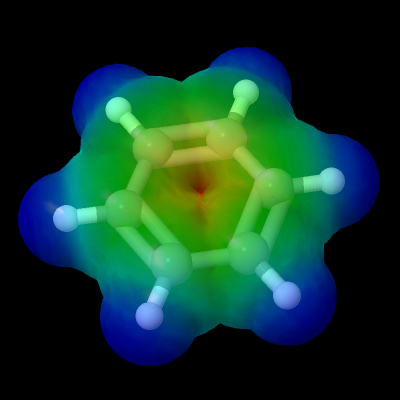
dove le aree in blu sono quelle più povere di elettroni e quelle in rosso quelle più ricche.
naftalene
Il naftalene è un altro improtante composto organico aromatico, piatto di formula C10H8.
Eccone il corrispettivo grafico degli orbitali di frontiera nel caso del naftalene.
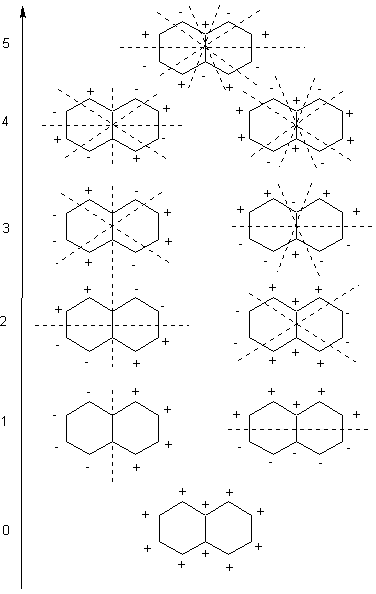 
Si può notare come il grafico in questo caso non rispetti la forma della molecola così come riportata;
basta però girarla di 60° per avere i livelli degli orbitali π1 (0 nodi),
π2 e π3 (1 nodo),
π4 e π5 (2 nodi), fino a qui risultano orbitali occupati o di legame,
seguono cinque orbitali di antilegame π6* e π7* (3 nodi),
π8* e π9* (4 nodi),
π10* (5 nodi).
Bibliografia
Giuseppe Striccoli 31 marzo 2011 http://pinostriccoli.altervista.org/
|