TEORIA DEGLI ORBITALI MOLECOLARI (2) MOLECOLE BIATOMICHE
Introdotta da Friedrich Hund e Robert S. Mulliken nel 1927 e 1928, un orbitale molecolare è rappresentato
da una funzione d'onda ψ il cui quadrato ψ2 descrive la distribuzione di probabilità
relativa alla posizione dell'elettrone.
Tale funzione d'onda si ottiene dall'equazione d'onda che descrive l'intera molecola, che in generale non è
di facile soluzione: questa problematica viene risolta mediante un'approssimazione che consiste nello scrivere
l'orbitale molecolare come combinazione lineare degli orbitali atomici dei singoli atomi.
Tale approssimazione è descritta dalla teoria degli orbitali molecolari.
ordine di legame
Si definisce inoltre l'ordine di legame come la semidifferenza tra il numero di elettroni leganti e il numero
di elettroni antileganti. L'ordine di legame è un indice della forza del legame stesso e viene
utilizzato estensivamente anche nella teoria del legame di valenza.
proprietà degli orbitali molecolari
Le proprietà principali degli orbitali molecolari così definiti sono:
- Il numero degli orbitali molecolari è pari al numero di orbitali atomici contenuti nella combinazione
lineare dalla quale sono costituiti, poiché gli stati stazionari non si creano né si distruggono;
- se la molecola possiede simmetrie, gli orbitali atomici degeneri, caratterizzati dalla stessa energia,
sono raggruppati in combinazioni lineari che appartengono alla rappresentazione del gruppo di simmetria;
- il numero di orbitali molecolari appartenenti alla rappresentazione di un gruppo è pari al numero
di orbitali atomici appartenenti a tale rappresentazione.;
- all'interno di una particolare rappresentazione, gli orbitali atomici si mischiano maggiormente tanto più
i loro livelli di energia atomici sono vicini.
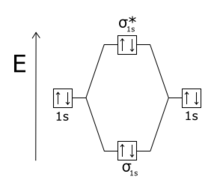 |
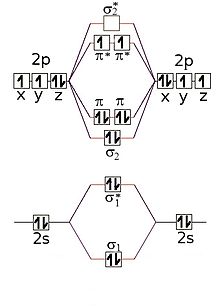 |
| Combinazione degli orbitali atomici 1s nella molecola biatomica omonucleare He2. In alto vi è la combinazioni antisimmetrica, che costituisce l'orbitale antilegante, in basso quella simmetrica, meno energetica, che costituisce l'orbitale legante. |
Combinazione degli orbitali atomici 2p e 2s nella molecola biatomica omonucleare O2. In alto vi sono le combinazioni degli orbitali atomici 2p, in basso quelle degli orbitali 2s. |
molecole biatomiche
Nelle molecole biatomiche omonucleari gli elettroni riempiono gli orbitali con lo stesso schema con cui avviene
il riempimento degli orbitali atomici, con l'unica eccezione che tra gli orbitali derivanti dagli orbitali
atomici 2p gli orbitali π hanno energia minore degli orbitali σ a causa del fatto che la repulsione
coulombiana degli orbitali derivati dagli orbitali atomici 1s e 2s aumenta l'energia degli stati σ.
Questo è dovuto al fatto che gli elettroni dei due legami σ sono situati nella regione tra i
due nuclei, e pertanto si respingono; nelle molecole più pesanti dell'ossigeno gli orbitali
π hanno energia minore e sono situati in prossimità dei nuclei, pertanto il naturale ordinamento energetico
è ristabilito.
La combinazione lineare delle funzioni d'onda che forma l'orbitale molecolare è rappresentata in alto, dove
sono schematizzate la molecola He2 e la molecola O2, la quale ha configurazione
elettronica:
σ1s2 σ1s* 2 σ2s2
σ2s* 2 σ2px2
π2py2 π2pz2
π2py* 1 π2pz* 1.
Nel caso di molecole biatomiche eteronucleari, se il numero atomico dei due atomi differisce di poco il
procedimento che forma gli orbitali è lo stesso delle molecole omonucleari.
Vi è tuttavia una differenza di elettronegatività tra i due atomi, e ciò implica la presenza di un dipolo
elettrico tra di essi dovuto al fatto che gli elettroni si distribuiscono nelle vicinanze dell'atomo più
elettronegativo: il legame che si viene a formare prende il nome di covalente polare.
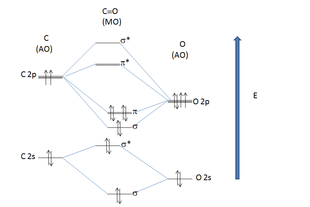
Situazione degli orbitali molecolari nel monossido di carbonio.
Se la differenza di elettronegatività è maggiore di un valore convenzionale fissato a 1,9
vi è un trasferimento completo di carica tra i due atomi, cioè la nuvola elettronica può considerarsi
come spostata completamente sull'elemento più elettronegativo.
Tale legame prende il nome di legame ionico.
Se il numero atomico dei due atomi differisce di molto accade che gli orbitali molecolari si formino tra
orbitali atomici con energia simile, invece che dello stesso tipo.
All'aumentare del numero di atomi coinvolti diventa complessa la caratterizzazione degli orbitali, a nell'ambito
della teoria degli orbitali molecolari sono stati sviluppati diversi metodi di calcolo degli orbitali, tra i
quali vi sono il Metodo di Hückel, proposto da Erich Hückel nel 1930, consiste in un semplice metodo L.C.A.O.
utilizzato per la determinazione delle energie degli orbitali molecolari di sistemi p rappresentati da
idrocarburi con legami coniugati, risultando applicabile a molecole quali ad esempio l'etilene, il benzene e
il butadiene.
La nota regola di Hückel trae origine da queste basi.
Il metodo di Hückel esteso, sviluppato da Roald Hoffmann, rappresenta invece la base delle regole di
Woodward-Hoffmann ed è un'estensione a tutti gli orbitali di valenza. Negli anni successivi il metodo
fu reso applicabile anche agli eterocicli come la piridina, il pirrolo e il furano.
Vi è infine il metodo di Pariser-Parr-Pople, che sfrutta metodi semi-empirici della chimica quantistica
nell'ambito della chimica organica.
Bibliografia
http://it.wikipedia.org
|