TEORIA DEGLI ORBITALI MOLECOLARI (1) L.C.A.O.
Molti libri illustrano la teoria, per la verità ormai superata, degli orbitali ibridi, in verità
si potrebbe iniziare direttamente dalla teoria degli orbitali molecolari come combinazione lineare di orbitali
atomici, acronimo C.L.O.A. (in inglese L.C.A.O. ossia Linear Combination Atomic Orbitals).
Il punto di partenza di questa teoria è quello di considerare che al legame tra gli atomi concorrono sia gli
elettroni spaiati (elettroni di valenza) che gli altri elettroni degli atomi che costituiscono la molecola.
Nella molecola quindi non esistono più elettroni appartenenti ai singoli atomi, ma essi sono tutti
ridistribuiti nella molecola su nuovi livelli energetici denominati orbitali molecolari.
Applicando l’equazione di Schrödinger ad una molecola, ovvero a un sistema formato da un insieme di elettroni,
si ottengono alcune soluzioni a questa equazione che descrivono sia l’energia del sistema, sia la sua forma
geometrica. A queste soluzioni matematiche è stato dato il nome di orbitali molecolari.
La formazione di una molecola biatomica a partire da due atomi uguali isolati posti a una distanza tale da poter
interagire tra loro, viene studiata matematicamente combinando linearmente, ovvero sommando o sottraendo, gli
orbitali atomici rappresentati dalle funzioni d’onda ψ dei due atomi.
Una tale combinazione lineare degli orbitali atomici va fatta in base a delle regole precise:
0) con combinazione lineare si intende l'utilizzo di operazioni di somma e sottrazione (con uso di opportuni
coefficienti definiti dal principio di normalizzazione delle funzioni d'onda ψ);
1) si possono combinare solo gli orbitali atomici con la medesima simmetria spaziale (vedi teoria dei gruppi); e
2) la combinazione è tanto maggiore quanto più gli orbitali hanno lo stesso livello energetico.
Quindi vanno sommati o sottratti tra loro gli orbitali atomici caratterizzati sia dalla stessa energia
(ad esempio l’orbitale atomico 1s di un atomo con quello 1s dell’altro atomo, l’orbitale 2s di un atomo con quello
2s dell’altro atomo e così via) sia dalla medesima orientazione spaziale (ad esempio l’orbitale atomico
2px di un atomo con l’orbitale atomico 2px dell’altro atomo).
Così sommando e sottraendo l’orbitale atomico 1s di un atomo con l’orbitale atomico 1s dell’altro atomo
si ottengono due nuove funzioni d’onda ψ (una ottenuta dall’operazione di addizione, l’altra dall’operazione
di sottrazione) che vengono denominate orbitali molecolari aconimo O.M. (in inglese M.O. molecular orbitals).
Queste due nuove funzioni d’onda ci forniscono non solo i valori dell’energia di questi orbitali molecolari, ma
ci danno, mediante la loro elevazione al quadrato ψ2, la distribuzione spaziale della nuvola elettronica
ad essi associata, ovvero la forma degli orbitali molecolari.
In particolare l’orbitale molecolare risultante dall’addizione di due orbitali atomici è caratterizzato da un’energia
minore di quella ottenuta sommando le energie dei due orbitali atomici di partenza.
Inoltre la densità elettronica di questo orbitale molecolare è simmetricamente distribuita attorno a una linea
congiungente i due nuclei, detta asse di legame, ed è massima tra i due nuclei stessi. Un simile orbitale molecolare
viene allora detto orbitale legante di tipo sigma simboleggiato con σ1s.
L’orbitale molecolare risultante invece dalla sottrazione dei due orbitali atomici 1s è caratterizzato da
un’energia maggiore di quella ottenuta sommando le energie dei due orbitali atomici di partenza. Inoltre la densità
elettronica di questo orbitale molecolare, anche se simmetricamente distribuita attorno all’asse di legame, risulta nulla
tra i due nuclei.
Tra questi ultimi si ha un piano nodale che rappresenta la regione dello spazio in cui è nulla la probabilità
di trovare l’elettrone. Un simile orbitale molecolare viene detto orbitale molecolare antilegante di tipo sigma
e simboleggiato con σ1s*.
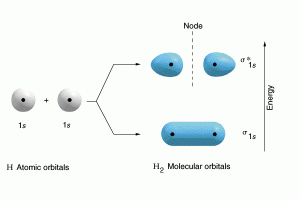
Quindi livelli energetici degli orbitali molecolari leganti e antileganti risultanti dalla combinazione atomica 1s di due
atomi uguali è rappresentata dalla seguente figura:
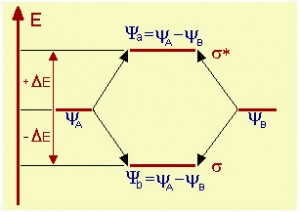
Parimenti combinando linearmente l’orbitale atomico 2s di un atomo con quello 2s dell’altro atomo si ottengono due nuove
funzioni d’onda ψ, vale a dire due orbitali molecolari: quello legante σ2s e quello antilegante σ
2s* le cui simmetrie sono del tutto simili a quelle degli orbitali atomici σ1s e
σ1s*.
Combinando linearmente i tre orbitali atomici 2p (2px, 2py e 2pz) di un atomo con i tre
orbitali atomici 2p dell’altro atomo, in modo da sommare o sottrarre coppie di orbitali con la stessa orientazione spaziale,
si ottengono sei orbitali molecolari: tre leganti e tre antileganti.
Nello specifico, tenuto conto che i tre orbitali atomici di tipo p sono orientati nello spazio lungo tre direzioni
perpendicolari tra loro, ne consegue che la combinazione di due orbitali atomici orientati come quelli px porta
alla formazione di un orbitale molecolare legante e di uno antilegante ambedue con simmetria equivalente rispetto all’asse
di legame.
Questi due orbitali vengono simboleggiati rispettivamente con σ2px e σ2px*.
La combinazione di due orbitali atomici orientati come quelli py porta alla formazione di un orbitale molecolare
legante e di uno antilegante caratterizzati da una simmetria detta π perché la densità della carica elettronica
non è simmetricamente distribuita attorno all’asse di legame, ma concentrata al di sopra e al di sotto del piano
contenente questo asse.
Nell’orbitale legante π2py la densità di carica è massima tra i due nuclei, mentre in quello
di antilegante π2py* la nuvola di probabilità è minima tra i due nuclei.
Infine la combinazione dei due orbitali atomici orientati come quelli pz porta alla formazione di un orbitale
molecolare legante e di uno antilegante simboleggiati rispettivamente con π2pz e π2pz*
caratterizzati anch’essi da una simmetria π.
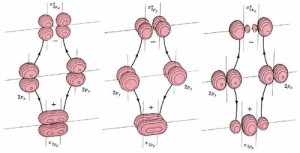
Nell'immagine che segue si riassume in grafico le tre situazioni, le prime due con simmetria perpendicolare all'asse di
legame (simmetria π) e la terza con simmetria parallela all'asse di legame (simmetria σ):
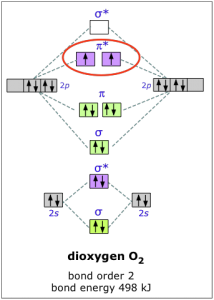
Si riportano le energie degli orbitali molecolari leganti e antileganti risultanti rispettivamente dalla combinazione
lineare degli orbitali atomici 1s, 2s, 2p di atomi uguali dove si evidenzia come la teoria sia in grado di dimostrare
come l'ossigeno sia un diradicale (molecola paramagnetica) diversamente dalle altre moelcole biatomiche.
Bibliografia
http://www.chimicamo.org
|