Ordine e disordine nelle soluzioni acquose (salamoia)
introduzione
Lo stato liquido si caratterizza per avere un volume relativamente costante al variare della
temperatura ma forma variabile, questo perché da un punto di vista microscopico le sue particelle
interagiscono tra di loro attraverso interazioni chimiche chiamate secondarie (o interazioni deboli)
che comunque le permettono di scorrere e muoversi le une rispetto alle altre, pur impedendo un
allontanamento reciproco.
il caso dell'acqua
L'acqua non è soltanto il 70-90% del peso della maggior parte delle forme di vita, ma rappresenta
anche la fase continua degli organismi viventi. Poiché è familiare e ubiquitaria, l'acqua
è spesso considerata un liquido blande e inerte, con l'unica funzione di riempire gli spazi vuoti
degli organismi viventi.
In realtà è estremamente interessante anche da un punto di vista chimico fisico.
Di seguito esaminiamo il concetto di ordine e disordine applicato alle molecole di acqua.
Dell'acqua, o H2O si conosce uno stato liquido, uno stato gassoso, detto vapore, ma diversi
stati solidi, il primo dei quali chiamato ghiaccio I, è un solido stabile a pressione atmosferica
sotto gli 0°C che presenta una struttura ordinata delle molecole di acqua, così ordinata che ha
una densità inferiore (ossia un volume specifico superiore) rispetto alla fase liquida.
In generale questa caratteristica non è riscontrabile in altre sostanze e l'acqua è una delle
poche eccezioni.
In prima approssimazione possiamo quindi considerare l'acqua liquida come avente le molecole completamente
disordinate (100% disordine 0% ordine) mentre il ghiaccio (ghiaccio I) come avente tutte le molecole
ordinate (0% disordine 100 % ordine). A 0°C le densità rispettive sono 0,99986 e 0,917.
come si vede dai seguenti diagrammi della densità in funzione della temperatura.
 
Si può da questi grafici determinare la densità dell'acqua liquida a 18°C (temperatura
comune dei laboratori) al valore 0,9985 g/mL ed estrapolare dal primo grafico la densità di
un ipotetico ghiaccio I sovrariscaldato al valore di circa 0,9135 g/mL.
soluzioni di acqua e sale (cloruro di sodio)
Il sale si scioglie in acqua con assorbimento di calore, ben evidenziabile se ne scigliamo grandi quantità,
per formare una soluzione chiamata, ad alte concentrazioni, salamoia. L'energia assorbita viene utilizzata per
rompere i legami ionici presenti nel reticolo cubico del cloruro di sodio tra ioni Na+ e Cl-,
e sostituirli con interazioni diverse ioni-acqua per formare degli acquaioni Na+(aq) e
Cl-(aq).
Molti testi spiegano che l'effetto degli ioni più semplici come gli ioni sodio Na+ e ioni
cloruro Cl- è quello di ordinare spazialmente la struttura locale delle molecole di
acqua in prossimità degli ioni stessi.
Un esperimento comune è quello di inserire in un matraccio da 100 mL, 50 mL di soluzione di acqua e sale
concentrata (per esempio al 20%) e depositarvi sopra 50 mL di acqua distillata, quindi dopo aver agitato
(per formare una soluzione circa al 10%) osservare una contrazione di volume per la soluzione che si è
appena formata.
Perché?
In effetti la densità delle soluzioni di acqua e sale è inferiore a quella che ci si dovrebbe
aspettare per il solo effetto di solvatazione, come se il sale 'occupasse del volume' anche dopo sciolto: la
situazione ideale prevede invece che il sale, una volta sciolto, non occupi più nessun volume nella
soluzione, ossia il volume di acqua non dovrebbe variare troppo dopo l'aggiunta del sale.
Se la situazione ideale fosse vera, esprimendo con g la quantità di grammi di sale sciolti in 100 mL di
soluzione, la densità d dovrebbe corrispondere a:
dideale = g/100 + 0,9985
In realtà si osserva che la densità reale di una soluzione di acqua e sale è sempre
ben inferiore a tale valore:
dreale < dideale = g/100 + 0,9985
e in effetti risulta compresa, tra 0 e 25 grammi di sale disciolto, tra i seguenti limiti:
g/100 + 0,9135 < dreale < g/100 + 0,9985
corrispondenti alle due situazioni estreme di avere una 'soluzione di sale in ghiaccio I' (temine a sinsitra) e di una soluzione
di sale in acqua dalle perfette capacità di solvatazione (termine a destra).
Un rapido esperimento in laboratorio ha portato alla realizzazione del seguente grafico della densità
in funzione della concentrazione:
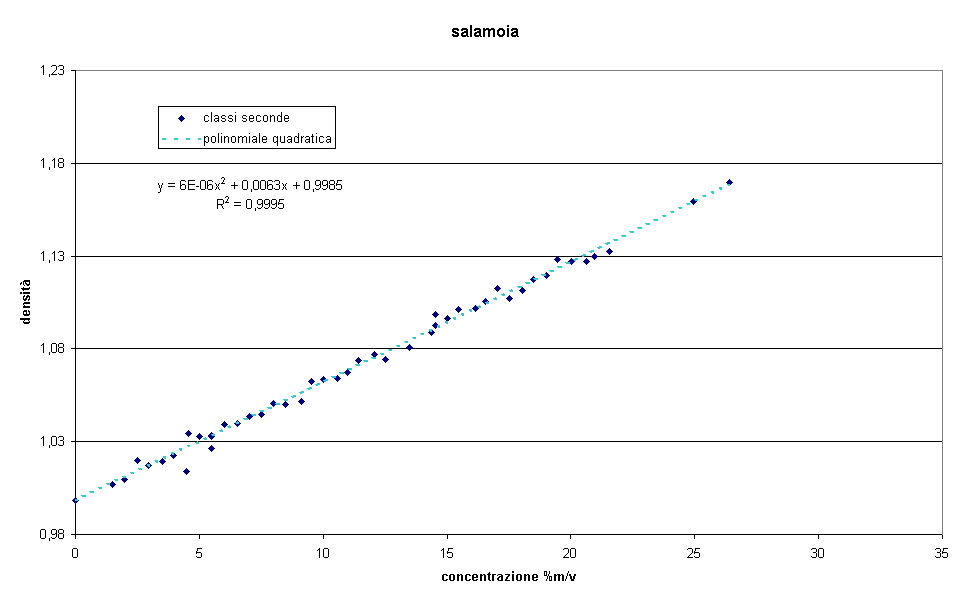
In sintonia con analoghi grafici densità concentrazione ritrovabili in rete.
Con un una curva di regressione (del secondo ordine) con un ottimo valore di R2 (talvolta indicato
anche come r2) anche considerato la dispersione dei dati, la variabilità degli operatori,
della vetreria (matracci da 100 mL) e delle bilance tecniche presenti nel nostro laboratorio.
Per i nostri dati la retta di regressione risponde alla formula:
densità = y = 0,000006 x2 + 0,0063 x + 0,99826
con x = g ossia quantità di grammi di cloruro di sodio disciolti in 100 mL di soluzione.
[cambiando il termine noto cambiano leggermente anche gli altri coefficienti]
Se queste premesse sono valide, possiamo interpretare le varie concentrazioni di sale in acqua in termini
di ordine e disordine, e calcolare con la semplice "regola della croce" la percentuale di ordine e disordine
esistente per diverse concentrazioni di acqua e sale:
| grammi in 100 mL |
% di disordine |
% di ordine |
| 0 |
100 |
0 |
| 5 |
78,5 |
21,5 |
| 10 |
57,2 |
42,8 |
| 15 |
36,4 |
63,6 |
| 20 |
15,9 |
84,1 |
| 25 |
0 |
100 |
Appare che, poiché è possibile raggiungere una solubilità massima di 29,6 g
in 100 mL (ossia 26,5 g in 100 g di soluzione) con densità circa 1,204 g/mL
è evidente che questa analisi diventa troppo semplice e bisogna prendere in considerazione anche
le dimensione o, meglio, il volume degli ioni coinvolti che sono numericamente significativi rispetto
alle molecole di acqua.
Alla concentrazione di 29,18 g in 100 mL infatti si ha un rapporto di particelle ioni : acqua = 1 : 5 !
Dalla teoria degli orbitali molecolari e dalla cristallografia si conosce che la il sale cristallizza
in un sistema cubico, ove cioé ogni ione si coordina con altri sei controioni, o anche che
la sfera di idratazione degli ioni Cl- è per lo più ottaedrica coinvolgente
quindi sei particelle di acqua (esaacquaione Cl-(aq) ). Questo sarebbe in accordo
col fatto che, in assenza di sufficienti molecole di acqua per ciascuno ione, il sale rimane indisciolto.
Riprendendo l'esempio precedente del mescolamento di una soluzione al 20% di acqua e sale con acqua distillata
ora appare evidente del perché si osservi una contrazione di volume: la quantità di
molecole di acqua che passano ad uno stato disordinato è più del doppio, e poiché
l'acqua 'disordinata' ha una densità più elevata dell'acqua 'ordinata', si ha una
contrazione di volume.
alcune riflessioni
Abbiamo quindi interpretato, o se si vuole, ipotizzato, per il termine di primo grado +0,0063 x < +0,01 x
una spiegazione in termini di ordine e disordine delle molecole di acqua nella soluzione.
Il termine di secondo grado molto piccolo, ma non ininfluente ad alte concentrazioni, +0,000006 x2,
potrebbe essere in relazione con il volume o interazione vicendevole degli ioni, e poiché risulta
molto variabile al variare dei punti della curva, andrebbe studiato in maggiore dettaglio per poter essere
interpretato.
All'aumentare della salinità, per quanto detto, aumenta il grado di ordine degli ioni nella
soluzione, ciò malgrado il punto di congelamento si abbassa secondo i principi delle proprietà
colligative; si può ipotizzare che la salamoia non è in grado di trovare un reticolo
cristallino adatto a soddisfare le interazioni tra idrogeno e ossigeno per formare il ghiaccio I (esagonale)
con le interazioni tra gli ioni sodio e cloro (cubico).
Ringraziamenti
Si ringraziano il tecnico Patrizia Leonardi e i colleghi Andrea Angelini e Franca Brusa per gli utili commenti.
Si ringraziano tutti gli alunni che hanno partecipato a questa esperienza, appartenenti alle
classi 2^D e 2^I dell'ITIS di Ravenna dell'anno scolastico 2017/2018.
BibliografiaAlbert H. Lehninger "Biochimica" II ed. Zanichelli
|