Capacità di scambio cationico e anionico del terreno
Generalità
Lo strato sottile superficiale della crosta terrestre da cui le piante prendono parte del nutrimento (componente
minerale) e l'acqua è chiamato terreno.
Il terreno, che ha caratteristiche fisiche e chimiche che lo distinguono da altre entità presenti in natura,
è un insieme di sostanze minerali e di sostanza organica.
In un terreno normale le sostanze minerali e la sostanza organica rappresentano il 50% del suo volume; il restante
50% è costituito da spazi vuoti, che sono occupati dall'aria e dall'acqwua in rapporti dovuti alle
precipitazioni.
I minerali più importanti del terreno sono i silicati e allumosilicati, un gruppo parimenti importante
di sostanze minerali è quello rappresentato dagli ossidi e idrossidi di ferro e alluuminio
nei quali prevalgono gli ioni positivi o cationi Si4+, Al3+, Fe3+
e gli ioni negativi o anioni O--, OH-.
Il contenuto di sostanza organica varia nei diversi terreni dall'1 al 6%. Nei terreni desertici la sostanza
organica è inferiore all'1% mentre nei terreni ricchi di humus raggiunge il 20-30%.
Semplificazioni
La chimica del suolo e degli allumosilicati si rivela moltocomplessa cnhe solo ad un piccolo esame, è necessario
ricorrere quindi ad alcune semplificazioni nelle formule di struttura al fine di rendere la cosa più chiara nei ù
limiti del verosimile.
La struttura dei silicati viene quindi rappresentata bidimensionalmente in forma di triangoli (nella realtà
sarebbero complessi tetraedrici) con presenza di legami ionici (nella realtà si hanno invece legami
covalenti polari e ionici).
esempio ione SiO3-- 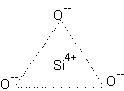
La struttura degli idrossidi di ferro e alluminio viene rappresentata bidimensionalmente in forma di quadrati
(nella realtà sarebbero complessi ottaedrici) con presenza di legami ionici e covalenti (non molto dissimile
dalla realtà in questo caso).
esempio ione Al(OH)4- 
Capacità di scambio cationica o CSC
Per semplificare il fenomeno riprendiamo il disegno precedente per rappresentare la silice di formula generale
SiO2 e qui rappresentata da una formula di struttura neutra del tipo Si2O4.
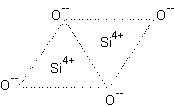
.
La silice è il componente principale della frazione sabbiosa dei terreni e non è in grado di svolgere
un'attività di scambio cationico o anionico, ed infatti i terreni sabbiosi e aridi hanno le più basse
capacità di scambi ionici sia cationico che anionico.
La sostituzione di un catione silicico Si4+ con uno alluminico Al3+ che ha una carica
positiva in meno genera un reticolo con carica negativa in grado di legare a se cationi con carica positiva,
per esempio consideriamo qui il semplice reticolo di AlSiO4-

Tali sostituzione può avvenire in quanto il raggio degli ioni Al3+ e Si4+ è simile.
Le argille sono infatti il componente inorganico del terreno maggiormetne responsabile dei fenomenid i scambio cationico.
Analogamente è possibile la sostituzione occasionale con ioni magnesio Mg++ che però pur aumentanto
la carica negativa del reticolo e quindi aumentando teoricamente la sua capacità di scambio cationica, nel
lungo periodo lo destabilizza perché il catione Mg++ non è in grado di trattenere gli anioni
ossido non avendo una forte carica positiva:
Si2O4 + Mg++ ⇔ MgSiO4-- + Si4+
MgSi2O4-- + H2O —» SiO3-- + Mg(OH)2
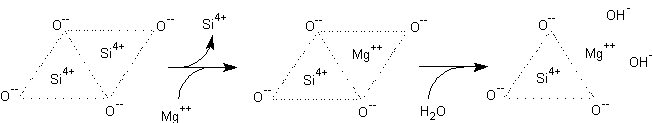
Per quanto riguarda la valenza e il volume, la capacità di un catione in soluzione di spostare cationi dal
reticolo dei silicoalluminati diminuisce dal torio al sodio:
Th4+ > La3+ > Ca++ > Na+
Nell'ambito dei cationi aventi la stessa carica di ha che la capacità di scambiare decresce dal litio allo ione idrogeno
seguando l'ordine di dimensione:
Li+ > Na+ > K+ Rb+ > Cs+ > H+
infatti lo ione idrogeno non va visto come H+ ma più correttamente come raggruppamento
poliatomico del tipo H9O4+ per cui possiamo scrivere più
intelligentemente:
Li+ > Na+ > K+ Rb+ > Cs+ > H9O4+
In altri termini il litio è: quello che coordinandosi meglio all'ossigeno tende a staccarsi meno degli altri
cationi.
Nel caso dei cationi bivalenti abbiamo come si può intuire facilmente che la capacità di scambiare decresce
nell'ordine:
Be++ > Mg++ > Zn++ > Co++ > Fe++ > Mn++ >
Ca++ > Sr++ > Ba++
sempre seguendo l'ordine crescente dei volumi dei diversi cationi.
Capacità di scambio anionica o CSA
I terreni hanno anche la capacità di adsorbire e scambiare anioni.
Responsabili della capacità di scambio anionico sono alcuniminerali e colloidi amorfi del terreno come
ossidi e idrossidi di Ferro e alluminio (ematite, gibsite, goetite).
Si distinguono due tipi di adsorbimento anionico: specifico e non specifico.
Nell'adsorbimento specifico l'anione non può essere scambiato perché esso è trattenuto sotto forma
di sale insolubile o è inserito nella struttura dei reticoli.
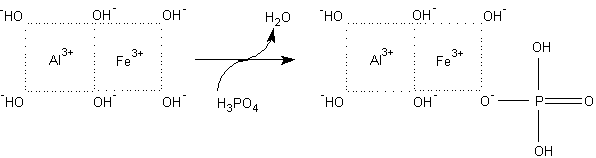
Prendiamo per esempio un ipotetico reticolo neutro ottaedrico del tipo AlFe(OH)6
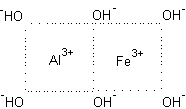
in ambiente acido esso reagisce col fosfato e solfato secondo per esempio la seguente reazioni irreversibile:
AlFe(OH)6 + H3PO4 —» AlFe(OH)4HPO4
+ 2 H2O

L'adsorbiemnto dei fosfati non è però sempre irreversibile; esso dipende dal pH*.
A pH neutro basici il legame del fosfato è meno stretto al reticolo secondo il seguente esempio:
AlFe(OH)6 + H3PO4 —» AlFe(OH)5H2PO4
+ H2O
Gli anioni fosfati esposti possono essere sostituiti nel complesso adsorbente per somministrazione di calcare
(formula chimica CaCO3) o calce spenta (formula Ca(OH)2).
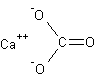
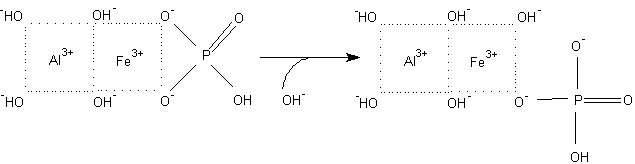
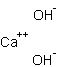 La calcitazione infatti fornisce gli ioni OH- (ambiente basico) che favoriscono la reazione:
La calcitazione infatti fornisce gli ioni OH- (ambiente basico) che favoriscono la reazione:
CaCO3 + H2O ⇔ Ca(HCO3)+ + OH-
AlFe(OH)4HPO4 + OH- —» AlFe(OH)5HPO4-
 Anche nei terreni alcalini per costituzione l'anione ortofosfato PO43- è reso indisponibile
per le piante, viene favorita infatti la formazione del fosfato tricalcico
Ca3(PO4)2 o di altre forme minerali quali fluoroapatite, idrossiapatite etc.
tutte insolubili.
Anche nei terreni alcalini per costituzione l'anione ortofosfato PO43- è reso indisponibile
per le piante, viene favorita infatti la formazione del fosfato tricalcico
Ca3(PO4)2 o di altre forme minerali quali fluoroapatite, idrossiapatite etc.
tutte insolubili.
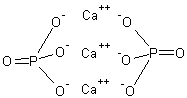
* La realtà è un po' più complessa: a pH bassi gli idrossidi di ferro e alluminio formano dei
complessi piccoli di formula Me6(OH)126+ che legano irreversibilmente il fosfato,
mentre a pH neutro o leggermente basico formano dei complessi grandi di formula: Me32(OH)8214+
che non legano saldamente il fosfato. Con Me abbiamo indicato un generico ione metallico con carica in questo esempio
trivalente positiva ossia Me+++.
L'adsorbimento non specifico è dato da gruppi chimici capaci di protonarsi, ossia di mantenere una carica
positiva che nel caso dei terreni sono il gruppo ammonio ed il gruppo idronio:
R-NH2 + H+ —» R-NH3+
R-OH + H+ —» R-OH2+
Poiché il legame tra l'anione e il gruppo positivo è debole, l'adsorbimento è facilmente
reversibile, per esempio:
R-NH3+OH- + NO3- ⇔
R-NH3+NO3- + OH-
oppure
R-NH3+OH- + Cl- ⇔
R-NH3+Cl- + OH-
L'adsorbimento non specifico è tanto più elevato quanto più basso è il pH del terreno.
Nell'adsorbimento aspecifico i più comuni anioni adsorbiti e scambiati sono in ordine decrescente:
I- > Br- ≈ NO3- > Cl- > F-
≈ OH- > SO4-- > CO3-- > PO43-
Bibliografia
Adolfo Ferrari "Trattato di chimica generale ed inorganica" 1965
Calvino Passera "Chimica agraria per istituti tecnici agrari e istituti professionali per l'agricoltura" Pàtron, Bologna 1983
Renato Strocchi "appunti di lezione di chimica agraria" 2016.
|