La cristallizzazione salina nei materiali da costruzioneL'esempio del sito archeologico di Nora in Sardegna
di Luigi Massidda e Ulrico Sanna - Università di Cagliari
L'aggressione salina può essere di tipo sia chimico che fisico. Alcuni sali infatti possono dar luogo a pericolose reazioni con alcuni manufatti: basti pensare al ben noto attacco solfatico sulle fasi alluminose delle matrici cementizie con formazione di ettringite e su quelle silicatiche con formazione di thaumasite; inoltre più di frequente possono agire fisicamente quando, in conseguenza dell’evaporazione dell’acqua, si creano le condizioni termodinamiche per la nucleazione e la crescita di cristalli.
A questo problema sono interessati, per le conseguenze che ne possono derivare, sia i monumenti di interesse storico-artistico che le comuni costruzioni.
Il degrado che accompagna il fenomeno della cristallizzazione è spesso di notevole entità, tanto che alcuni edifici sono andati perduti ed altri sono ormai gravemente compromessi (vedi figura mostrante il sito archeologico di Nora, Sardegna danneggiato dalla cristallizzazione dei sali).
Il processo di assorbimento di soluzioni saline (tra i sali solubili più comuni si possono citare: cloruri, solfati, carbonati e nitrati di sodio, potassio, calcio e magnesio), avviene prevalentemente tramite risalita capillare dal terreno. Ma può manifestarsi anche per altra via, come succede per esempio nelle zone vicine al mare, per trasporto dell’aerosol marino da parte del vento.
Non bisogna, inoltre, trascurare il fatto che gli stessi materiali utilizzati nelle costruzioni contengono spesso al loro interno dei sali solubili che l’ acqua può disciogliere, trasportare attraverso la struttura porosa, e fare accumulare in alcune zone dove particolari condizioni termo-igrometriche ne potranno favorire la cristallizzazione.
Il ripetersi di cicli di assorbimento (delle soluzioni) ed evaporazione (del solvente acqua), così come i cicli di cristallizzazione e solvatazione (cioè dissoluzione dei cristalli per ingresso di acqua), contribuiscono ad aumentare progressivamente la quantità di sale all’interno del materiale con la possibile creazione di zone di accumulo preferenziale. Il deterioramento del materiale parte generalmente dalla superficie e comincia con fenomeni di distacco superficiale nel caso di pietre o mattoni, o con lo sfarinamento nel caso delle malte, per proseguire poi con manifestazioni sempre più pericolose.
I parametri che controllano il fenomeno sono sostanzialmente tre: ventilazione, porosità e natura del sale. In zone poco ventilate, la velocità di evaporazione dell’acqua dalla soluzione risulta minore della velocità di trasporto della soluzione attraverso i pori del materiale, per cui gli ioni vengono trascinati fuori dalla matrice dando così origine ad una cristallizzazione esterna nota come "efflorescenza", manifestazione dal punto di vista estetico non certamente gradevole, ma facilmente eliminabile, ad esempio, con la semplice spazzolatura della superficie.
Ben più gravi possono essere le conseguenze se, per contro, la struttura risulta esposta a forte ventilazione; in questo caso la velocità di evaporazione è maggiore della velocità di trasporto della soluzione ed il sale cristallizza all’interno della matrice porosa dando origine a "sub-florescenze",
non visibili, ma certamente molto più pericolose delle "efflorescenze". Per quel che riguarda la porosità, più che del volume totale di vuoti presenti, è importante in questo contesto tenere conto della loro distribuzione dimensionale.
Secondo l'approccio termodinamico di Everett (spesso usato per calcolare le pressioni che si determinano all’interno di una matrice porosa in seguito alla transizione liquido-solido dell’acqua), la pressione Pr che si sviluppa in seguito alla cristallizzazione di un sale di tensione interfacciale g in un sistema poroso idealizzato con due classi di pori comunicanti di raggio r ed R (con R>r) è data dalla relazione:
Pr = 2 g (1/r - 1/R) [ 1]
ed ipotizzando R >> r, la [ 1] diventa:
Pr ~ 2 g 1/r [ 2]
La pressione di cristallizzazione, quindi, sarà tanto maggiore quanto più piccolo sarà il raggio medio dei pori e quanto maggiore sarà la tensione interfacciale g.
Le sollecitazioni indotte all’interno dei materiali dipendono quindi sia dalla natura del sale
(attraverso g), sia dalle caratteristiche chimiche e strutturali del materiale, che potrà o meno resistere in
dipendenza delle sue caratteristiche meccaniche.
Considerando sistemi aventi una porosità distribuita, caratterizzata cioè della presenza di differenti classi dimensionali, risulta più appropriato utilizzare gli sviluppi di questa relazione secondo quanto proposto da Fitzner e Snethlage onde considerare i contributi pesati delle differenti classi dimensionali:
Pr = g Pri Xri [3] dove Xri = Vri /VR , e Vri il volume dei pori di dimensione ri, supposti connessi ai pori di dimensione R (di volume VR).
Un esempio emblematico della validità di questo approccio, è dato dal confronto fra due materiali che compongono l’opus caementicium nel sito archeologico di Nora, un’importante città
portuale del periodo punico-romano nei pressi di Cagliari: un’arenaria scarsamente cementata e quindi
molto porosa, presente sotto forma di conci di diversa pezzatura che costituisce l’aggregato, e una malta
di calce che rappresenta la fase legante di questo "antico" calcestruzzo.
Questo sistema, sottoposto ad una forte aggressione da parte dell’aerosol marino, manifesta pesanti segni di deterioramento evidenti sopratutto per uno dei due materiali.
L’arenaria, pur essendo meccanicamente più debole dalla malta (le resistenze a compressione sono rispettivamente pari a 3,2 MPa per l’arenaria e 7,6 MPa per la malta, mentre la
resistenza a trazione, che rappresenta il parametro che in questo caso deve essere considerato, può stimarsi
pari a circa 1/10 di questi valori) appare assai meno aggredita dai sali, nella fattispecie costituiti in prevalenza da cloruro di sodio.
Le distribuzioni porosimmetriche relative ai due materiali messe a confronto nel grafico a lato (Distribuzione dimensionale dei pori nella arenaria e nella malta nell'opus caementicium di Nora) permettono di spiegare questa apparente anomalia.
Le pressioni di cristallizzazione nell’arenaria calcolate tramite il modello di Fitzner e Snethlage sono risultate comprese tra 1.0 e 4.0 MPa mentre i valori relativi alle malte di calce sono stati sempre superiori, talvolta anche di un ordine di grandezza.
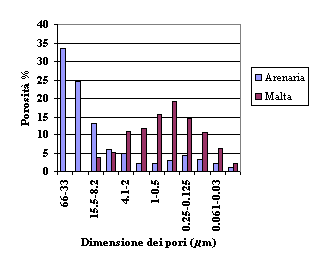 Le malte quindi, per quanto meccanicamente più resistenti, sono potenzialmente più aggredibili dell’arenaria la cui struttura porosa, contenente in prevalenza pori di dimensione di qualche decina di mm, risulta in grado di "accomodare" meglio i processi espansivi dovuti alla cristallizzazione dei sali.
Le malte quindi, per quanto meccanicamente più resistenti, sono potenzialmente più aggredibili dell’arenaria la cui struttura porosa, contenente in prevalenza pori di dimensione di qualche decina di mm, risulta in grado di "accomodare" meglio i processi espansivi dovuti alla cristallizzazione dei sali.
E’ proprio la distribuzione dei vuoti a rappresentare, quindi, il parametro critico per valutare
la potenziale pericolosità di un materiale sottoposto ad aggressione salina, in stretta analogia con i criteri di valutazione della sua gelività.
Il problema della cristallizzazione salina è però complicato da un ulteriore fattore. Alcuni sali infatti possono cambiare formula, struttura cristallina e volume specifico in funzione della temperatura e dell’umidità relativa.
Il solfato di sodio, ad esempio, esiste in due forme stabili: una forma anidra Na2SO4), nota come Thenardite che cristallizza ortorombica ed ha
un volume molare pari a 53 cm3/mole, ed una decaidrata (Na2SO4.10H2O) che cristallizza monoclina nota come Mirabilite di volume molare pari a 220 cm3/mole; esiste, inoltre, una forma metastabile con sette molecole di acqua di cristallizzazione. A pressione atmosferica, la temperatura di transizione dalla forma anidra a quella eptaidrata è di circa 23°C, mentre a quella della decaidrata è di 32°C, valori questi che nei climi temperati sono facilmente attraversabili anche più volte nell’arco della stessa giornata.
Nella transizione Thenardite-Mirabilite si verifica un incremento di volume superiore al 300% con l’instaurarsi quindi di elevatissime pressioni di idratazione (Tabella 1), in determinate condizioni termoigrometriche, che provocano sollecitazioni insopportabili per la maggior parte dei materiali da
costruzione porosi.
Tabella 1 - Pressioni di idratazione del solfato di sodio (MPa).
Umid. rel. % |
Temperatura °C
|
20 |
25 |
31
|
32,4 |
100 |
48.3 |
40.0 |
28.5 |
25.2 |
95 |
40.8 |
32.3 |
23.0 |
17.6 |
90 |
33.1 |
24.6 |
13.5 |
9.3 |
85 |
25.2 |
15.8 |
5.0 |
1.0 |
80 |
16.2 |
7.0 |
0 |
0 |
75 |
6.6 |
0 |
0 |
0 |
Alla luce di tutte queste considerazioni, risulta estremamente difficile poter fare delle previsioni circa la durabilità di una struttura soggetta ad aggressione per cristallizzazione salina anche se non è impossibile valutarne perlomeno la pericolosità latente.
Un’analisi dei sali solubili presenti, associata ad una accurata indagine porosimetrica dei materiali insieme alle loro proprietà meccaniche, può rappresentare un indispensabile strumento per poter fare alcune ipotesi al riguardo.
Qualora queste indagini mettessero in evidenza pericolose presenze di sali bisognerà provvedere ad impedirne un loro ulteriore ingresso e contemporaneamente evitarne pericolosi movimenti intercettando l’ingresso dell’acqua attraverso barriere orizzontali, polimeri idrofobizzanti, coperture ecc.
Una particolare attenzione deve essere, infine, posta all’uso di consolidanti: infatti, a fronte di un sicuro miglioramento delle proprietà meccaniche si verificano riduzioni della porosità che possono portare ad un peggioramento della durabilità quando i pori grandi, parzialmente occlusi dal consolidante, vengono "trasformati" in pori di più piccola dimensione, con conseguenti maggiori pressioni di cristallizzazione dei sali.
Bibliografia
Autori Vari "Manuale dei Materiali per l'Ingegneria" AIMAT, Ed. McGraw Hill Milano 1996
D.H. Everett "The Thermodynamics of Frost Damage to Porous Solids" in Transactions fo the Faraday Society, vol. 57, 1961, pp 1541-1551
B. Fitzner, R. Snethlage, Über Zusammenhänge zwischen Salzkristallizationsdrunk und Porenradienverteilungd, GP News Letter, vol.3, 1982, pp 13-24
|