SAGGI SUGLI ALCOLI
generalità
Gli alcoli sono composti organici contenenti carbonio, idrogeno e ossigeno, l'ossigeno contenuto esclusivamente nel gruppo funzionale C-O-H. Gli alcoli più semplici possono essere classificati in primari, secondari e terziari a seconda che il carbonio legato al gruppo –OH sia legato rispettivamente ad uno, due o tre gruppi alchilici:

Tale classificazione è importante a causa delle diversa reattività dei tre tipi di alcol.
Si possono effettuare dei test per determinare se un alcol è primario, secondario o terziario e tali analisi possono essere fatte secondo diverse procedure:
1) Saggio di Lucas
2) Saggio con acqua di bromo
3) Saggio dell’acido cromico o ossidazione di Jones
4) Saggio di Ritter
Saggio di Lucas
Il saggio di Lucas (reattivo costituito da acido cloridrico concentrato e cloruro di zinco anidro) serve a distinguere gli alcoli primari dai secondari e dai terziari ed è basato proprio sulla loro diversa reattività e quindi sulla diversa velocità di formazione dell'alogenuro alchilico.
Il saggio è applicabile solo agli alcoli solubili nel reagente di Lucas (in pratica agli alcoli inferiori all'esanolo).
Materiale: Provette, Contagocce, Becker, fornello bunsen, bacchetta di vetro.
Reagenti:
alcool primario: alcool etilico (etanolo)
alcool secondario: alcool sec-butilico (2-butanolo)
alcool terziario: alcool terz-butilico (2-metil-2-propanolo)
Reattivo di Lucas (HCl(aq) conc. e ZnCl2)
Procedimento: Si pone in una provetta circa 1 ml. di reattivo di Lucas e vi si addizionano una alla volta 4-5 gocce di alcol da esaminare.
Con gli alcoli terziarisi ha intorbidimento della soluzione dovuto alla formazione dell'alogenuro alchilico immiscibile nella soluzione acquosa.
Gli alcoli secondari reagiscono dopo due minuti a caldo e a bagno Maria.
Fare attenzione! Le provette vanno poste a bagno Maria solo dopo aver spento la fiamma del Bunsen).
Gli alcoli primari non intorbidano la soluzione.
Le reazioni che avvengono sono le seguenti:
RCH2OH + H+ + Cl- —» RCH2Cl + H2O reazione lentissima
R2CHOH + H+ + Cl- —» R2CHCl + H2O reazione graduale
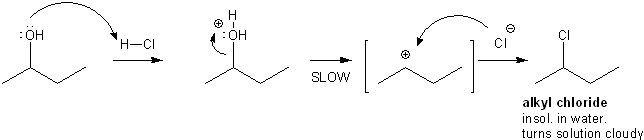
R3COH + H+ + Cl- —» [ R3COH2+ ] —» [ R3C+ + Cl- ] —» R3CCl + H2O reazione veloce
| alcoli | alcool primario | alcool secondario | alcool terziario |
| Saggio di Lucas | nessuna reazione | intorbidimento a bagno Maria
dopo cinque minuti | intorbidimento immediato (agitare piano) |
| meccanismo di reazione | SN2 | meccanismo misto SN1 ed SN2 | SN1 |
L'intorbidimento è causato dalla diversa solubilità in acqua dell'alcool (solubile) e dell'alogenuto
alchilico (meno solubile) prodotto della reazione.
Saggio con acqua di bromo
il bromo in soluzione acquosa Br2 (aq) ossida un alcol primario a un’aldeide (e
successivamente a un acido carbossilico); un alcol secondario, invece, viene ossidato a chetone
mentre un alcol terziario non reagisce in quanto nessun idrogeno può essere perso dal carbonio
che è legato al gruppo -OH.
Reagenti:
alcool primario: alcool etilico (etanolo)
alcool secondario: alcool sec-butilico (2-butanolo)
alcool terziario: alcool terz-butilico (2-metil-2-propanolo)
acqua di bromo: bromo in acqua, risultano presenti le speci chimiche acido ipobromico e bromuro
in base all'equilibrio:
Br2 + OH- «—» HBrO + Br-
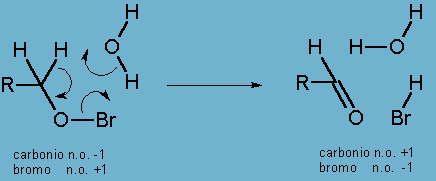
Meccanismo di reazione: la reazione non procede con meccanismo radicalico, per cui si suppone che tutti
i trasferimenti di elettroni avvengano a coppie.
Un possibile meccanismo può essere quindi il seguente:
dapprima si instaura un equilibrio tra l'alcool e l'ipobromito alchilico:
RCH2OH + HBrO «—» RCH2OBr + H2O
quindi in un meccanismo concertato dove interviene una molecola di acqua di ha in pratica il passaggio
di una coppia di elettroni dal carbonio al bromo con ossidazione del primo, e riduzione del secondo:
Procedimento: si pongono in una provetta 1-2 mL. di alcool da esaminare e vi si aggiungono una
alla volta alcune gocce di acqua di bromo. Si noterà la decolorazione del bromo e il tempo di
reazione varierà dalla diversa reattività degli alcoli.
| alcoli | alcool primario | alcool secondario | alcool terziario |
| Saggio di Lucas | nessuna reazione | intorbidimento a bagno Maria dopo cinque
minuti | intorbidimento immediato (agitare piano) |
| Saggio con bromo | decolorazione veloce a bagno Maria | decolorazione a
bagno Maria | nessuna reazione |
Nel saggio con bromo il tempo di decolorazione decresce dall'alcol primario al secondario.
Saggio dell’acido cromico o ossidazione di Jones
L’acido cromico in soluzione acquosa H2CrO4 (aq) ossida un alcol primario a
un’aldeide e successivamente a un acido carbossilico; un alcol secondario, invece, viene ossidato
a chetone mentre un alcol terziario non reagisce in quanto nessun idrogeno può essere perso dal
carbonio che è legato al gruppo -OH.
In una provetta vengono messi 2 mL di acetone e 3-4 gocce dell’alcol e, dopo aver aggiunto 2 gocce
di acido cromico si agita vigorosamente; a seconda dell’alcol avvengono le seguenti reazioni:
 Quando avviene la reazione di ossidazione dell’alcol il cromo passa da numero di ossidazione + 6 a
numero di ossidazione +3 e quindi la soluzione vira al color verde (tipico dello ione Cr3+).
Quando avviene la reazione di ossidazione dell’alcol il cromo passa da numero di ossidazione + 6 a
numero di ossidazione +3 e quindi la soluzione vira al color verde (tipico dello ione Cr3+).

Saggio di Ritter
Tale saggio è analogo a quello dell’acido cromico e fornisce lo stesso tipo di informazioni.
Gli alcoli primari e secondari vengono ossidati dal permanganato di potassio ad acidi carbossilici e
chetoni rispettivamente mentre gli alcoli terziari non danno alcuna reazione. Nel saggio di Ritter il
manganese viene ridotto dallo stato di ossidazione +7 in cui si presenta di colore rosso-viola a
stato di ossidazione +4 in cui si presenta di colore bruno insolubile.
Le reazioni (non bilanciate) coinvolte sono le seguenti:
RCH2OH + MnO4- —» RCOOH + MnO2
R2CHOH + MnO4- —» RCOR + MnO2
R3COH + MnO4- —» nessuna reazione e il colore della soluzione di
permanganato non cambia.
In una provetta vengono messi 2 mL di acido acetico e 3-4 gocce dell’alcol e, dopo aver aggiunto il
permanganato di potassio di agita vigorosamente.
La comparsa di una colorazione bruna dovuta alla formazione di diossido di manganese è indice
della presenza di un alcol primario o secondario. Si deve far attenzione ad aggiunger una minima
quantità di permanganato di potassio in quanto se ne viene messo un eccesso la colorazione
rosso-viola persiste anche in presenza di un alcol primario o secondario dando un falso negativo.
Il saggio risulta positivo anche per la presenza di doppi legami (alcoli allilici, ecc.) bisogna
quindi confrontare i diversi saggi al fine di avere una prova certa.
Bibliografia
T.W. Graham Solomons "Chimica organica" 1988
http://www.chimicamo.org/chimica-organica/analisi-qualitativa-degli-alcoli.html
http://www.myttex.net/forum/Thread-Reattivo-di-Deniges-per-citrati
http://www.itisravenna.gov.it/corso/chim/organica/organica1/riconoscimento_della_funzione_al.htm
https://it.m.wikipedia.org/wiki/Saggio_di_Lucas
http://www.itisravenna.gov.it/corso/chim/lab_org1.htm
http://www.chimicamo.org/chimica-organica/analisi-qualitativa-degli-alcoli.html
|