![]() Home page
Home page
![]() torna
al menu quarte classi
torna
al menu quarte classi
SOLUZIONI TAMPONE
1. Definizione
Il termine soluzione tampone indica
comunemente quelle soluzioni di elettroliti che limitano entro un campo molto
ristretto le variazioni del pH allorché ad esse vengono aggiunte quantità
moderate di un acido o di una base.
Se
l’effetto tampone si verifica solo per l’aggiunta di una base o solo
per l’aggiunta di un acido, il tampone si definisce unilaterale.
Se
l’effetto tampone si verifica indifferentemente per l’aggiunta di un acido o di
una base, il tampone si definisce bilaterale.
Dal
punto di vista pratico i tamponi bilaterali sono più importanti e più usati.
Essi, di solito, sono costituiti da una soluzione contenente un acido debole e un suo
sale con una base forte, ad esempio acido
acetico (CH3COOH) e acetato di sodio (CH3COONa), o una base debole e un suo sale con un acido forte, ad esempio ammoniaca (NH3) e cloruro di
ammonio (NH4Cl). Sono tamponi bilaterali anche sali derivati da acido e base entrambi deboli (es. acetato di ammonio, CH3COO-NH4+)
e i sali acidi di
acidi poliprotici deboli.
2.
Meccanismo d’azione
delle soluzioni tampone
L’azione
delle soluzioni tampone sul pH può essere spiegata nel modo seguente, in
riferimento al caso che si usi come tampone una soluzione di un acido debole e
di un suo sale con una base forte. In una tale soluzione, contenente, ad
esempio, la coppia acido acetico - acetato di sodio, si verifica
la dissociazione dell’acido debole:
![]()
Cui
compete la costante di dissociazione:
![]()
Il
sale risulta totalmente dissociato:
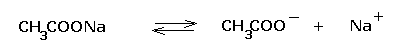
In sostanza il sistema contiene un acido debole (CH3COOH)in presenza della sua base di Brönsted coniugata (CH3COO-). Quest’ultima si idrolizza secondo il seguente equilibrio:
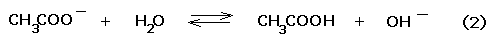
Quando nella soluzione viene introdotta una piccola quantità di un acido forte (ad esempio HCl), la base ione acetato, più forte della base acqua, lega a se i protoni, secondo la reazione
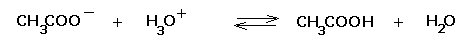
Limitando perciò efficacemente la presenza di protoni liberi nella soluzione. Il pH si abbassa in misura molto più limitata di quello che si sarebbe verificato aggiungendo l’acido forte ad una soluzione non tamponata.
Quando poi viene introdotta nella soluzione tampone una piccola quantità di base forte, gli ioni ossidrile OH- dissociati dalla base si associano ai protoni provenienti dall’acido acetico
![]()
E questo equilibrio acido-base si oppone efficacemente ad un notevole aumento del pH.
Analoghe considerazioni valgono
per soluzioni tampone costituite da una base debole in presenza di un suo sale
con un acido forte, ad esempio il sistema ammoniaca – cloruro di ammonio (NH3
- NH4Cl)
In esse si instaura l’equilibrio di dissociazione della base debole:
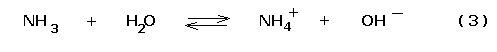
Cui compete la costante di dissociazione
![]()
e insieme la dissociazione praticamente completa del sale
![]()
Si ha così una soluzione di una base debole (NH3) in presenza dell’acido di Brönsted coniugato (NH4+).
Se si aggiungono piccole quantità di un acido forte, la base debole ammoniaca si associa ai protoni provenienti dall’acido
![]()
Limitando così l’abbassamento del pH. Se invece si aggiungono piccole quantità di una base forte, lo ione ammonio neutralizza gli ioni ossidrile
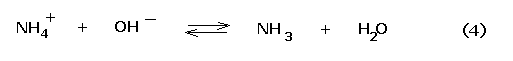
Limitando così l’innalzamento del pH.
3. Calcolo del pH delle
soluzioni tampone
In una soluzione tampone costituita da un acido debole e da un suo sale con una base forte, come ad esempio il sistema acido acetico – acetato di sodio, si verificano, come abbiamo già visto nel paragrafo 2, i seguenti equilibri:
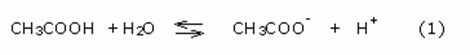
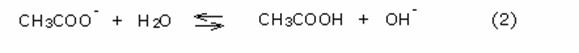
L’equilibrio (1), regolato dalla costante di acidità Ka,
risulta spostato verso sinistra a causa della presenza degli ioni acetato, che
compaiono al secondo membro dell’equazione, derivanti dal sale acetato di
sodio, totalmente dissociato. In tali condizioni l’acido acetico risulta
praticamente indissociato.
L’equilibrio (2), regolato dalla costante di idrolisi Ki
dello ione acetato, risulta anch’esso spostato a sinistra a causa della
presenza nella soluzione dell’acido acetico, che compare al secondo membro
dell’equazione. In tali condizioni l’idrolisi dello ione acetato è praticamente
irrilevante. I due equilibri si inibiscono a vicenda.
Possiamo perciò concludere che le concentrazioni dell’acido acetico e dello ione acetato sono praticamente coincidenti con i rispettivi valori analitici delle concentrazioni dei due componenti, Ca e Cs.
Considerando allora la costante di acidità dell’acido acetico
![]()
al posto delle espressioni generiche delle concentrazioni dello ione acetato e dell’acido acetico, possiamo inserire rispettivamente i valori Cs e Ca (per quanto sopra detto):
![]()
da cui ![]()
Conoscendo quindi la concentrazione degli ioni idrogeno, calcolando il logaritmo negativo di questa quantità si determina il pH.
Con lo stesso ragionamento si può determinare il pH di soluzioni tampone costituite da una base debole in presenza di un suo sale con una acido forte, come ad esempio il sistema ammoniaca – cloruro di ammonio. In sistemi del genere si può facilmente dimostrare che:
![]()
dove Cb e Cs sono rispettivamente le concentrazioni analitiche della base debole e del suo sale con un acido forte. Conoscendo la concentrazione degli ioni ossidrile si può determinare il pOH, e quindi dalla relazione pH + POH = 14 il corrispondente valore del pH
1. Potere tampone
Il potere tampone (b) di una soluzione tampone è dato dal rapporto tra gli equivalenti di un acido forte (DCa) o di una base forte (DCb) aggiunti per ogni litro di soluzione e la conseguente variazione del pH (DpH):
![]() o
o
![]()
In altre parole, il potere tampone rappresenta la quantità (espressa in equivalenti/litro) di acido forte o di base forte che si deve aggiungere alla soluzione affinché il pH vari di una unità.
Quindi quanto più alto è il valore di b tanto più alto è il potere tampone del sistema considerato. Il potere tampone dipende sia dalla natura, sia dalla concentrazione degli elettroliti costituenti il tampone.