|
bibliografia essenziale
J. Peuvot et al. (Belgio) J. Theor.biol. (1999) 198,
173-181
R. Brasseur et al.(Belgio) TIBS 22 MAGGIO 1997, 167-171
G. Saberwal, R. Nagaraji (India) Biochimica et Biofisica Acta 1197
(1994), 109-131. |
|
Il problema della resistenza dei batteri agli
antibiotici classici, tipo penicilline e cefalosporine, a causa del loro
uso massiccio è ormai assodato. Per questo la ricerca si sta orientando
verso lo studio di nuove sostanze in grado di sostituire i vecchi
antibiotici in modo da non manifestare l’indesiderato effetto della
resistenza. È stato visto che alcune sostanze hanno questi requisiti
perché agiscono in maniera diversa rispetto ai vecchi antibiotici. Gli
antibiotici classici sono attivi perché vanno ad interferire con la
sintesi della parete cellulare dei batteri, mentre questi probabili
antibiotici di nuova generazione, inducono una permeabilizzazione della
membrana cellulare che in seguito porta alla morte della cellula. La vita
cellulare esiste infatti perché c’è una separazione tra l’interno
della cellula ed il mondo esterno. Questa divisione è assicurata dalle
membrane biologiche che sono costituite essenzialmente di lipidi e
proteine. Queste membrane possono essere viste come delle barriere che
impediscono un contatto prolungato tra il dominio intracellulare ed il
liquido extracellulare. Queste sostanze bioattive sono dei peptidi, in
parole povere delle proteine molto piccole, infatti sono costituiti da un
massimo di 30 amminoacidi. Si possono posizionare in maniera particolare
rispetto alle membrane cellulari causando la morte della cellula, per
questo sono detti CITOTOSSICI.
Possono agire con 2 diversi meccanismi:
· Possono disporsi parallelamente alla superficie
della membrana cellulare ricoprendola completamente, e modificando la sua
tensione superficiale causarne l’implosione. · Oppure possono
aggregarsi a formare una specie di foro, un vero e proprio buco, che
risulti perpendicolare alla superficie della membrana e che causi il
rilascio del materiale intracellulare.
Oltre alla classe dei peptidi citottosici, vorrei
evidenziarne un’altra, a mio avviso molto affascinante, quella dei
PEPTIDI DI FUSIONE. Questi peptidi sono delle subunità, dei pezzi di
proteine più grandi implicati in processi biologici tipo la fecondazione
spermatozoo-uovo, la fusione dei mioblasti (cellule embrionali da cui si
originano le fibrocellule della muscolatura liscia e striata) e la morte
cellulare causata da infezioni virali o infestazioni parassitarie. Queste
sostanze aprono ampie prospettive di ricerca nello studio della fusione
delle membrane e dei fenomeni di adesione cellulare. Composti che possono
interferire con le funzioni di questi peptidi potrebbero avere un
considerevole interesse terapeutico come antivirali, antiinfettivi o
antimetastatici( per le cellule tumorali)...o un considerevole interesse
commerciale come per gli effetti anticoncezionali associati a queste
terapie!
Per ora si sa solo che questi peptidi si inseriscono
obliquamente rispetto alla superficie della membrana cellulare. Ancora non
è chiaro come possono dar luogo ai vari processi di fusione, ma per il
momento sono state identificate le proteine responsabili di ciò:
La meltrina α
dei mioblasti, l’emagglutinina del virus dell’influenza, la proteina S
del virus dell’epatite B, un sottodominio del virus di Ebola, la
proteina CS della malaria di cui sono affetti nel mondo ancora 280 milioni
di persone. Un dominio della proteina β
amiloide del morbo di Alzheimer...
Nonostante la ricerca farmaceutica non sia ancora in grado di
impossessarsi di tutti i meccanismi e i processi di fusione esprime in
questo campo una nuova risposta, seppure parziale e soggetta a
valutazioni, ai vecchi e antichi nemici dell'uomo e della sua salute
fisica !
|
|
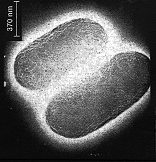
Prima
dell'attacco del peptide la cellula è intatta e si presenta al
microscpopio elettronico come la figura soprastante.
Dopo l'attacco
del peptide, che permeabilizza la membrana, la cellula invece degenera
fino alla condizione della figura sottostante.
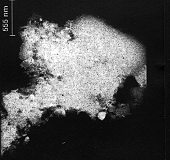
I peptidi
citotossici interagnedo con le cellule ne causano la rottura liberando
tutto il contenuto intracellulare.
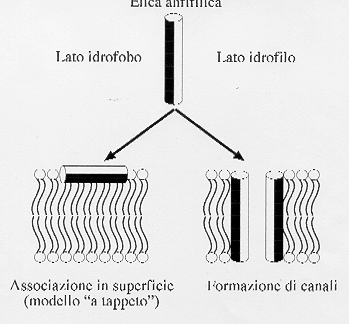
il peptide che
nella figura è rappresentato dal cilindretto bianco e nero ha un lato
idrofilo e uno idrofobo così che può disporsi sia parallelamente che
perpendicolarmente al doppio strato lipidico che costituisce la membrana
biologica ( si ricorda che il doppio strato fosfolipidico ha teste polari
idrofile e code apolari idrofobe).

Si sa che i
peptidi di fusione si dispongono obliquamente rispetto al doppio strato
lipidico favorendo la fusione delle membrane.
Ancora non si
conoscono precisamente quali siano i meccanismi d'azione che provocano la
fusione.
|

![]()
![]() Politica
Cultura
Scienze
Società
Religione
Psiche
Filosofia
Ambiente Arte
Cinema
Sport
Napoli
Università
Home
Politica
Cultura
Scienze
Società
Religione
Psiche
Filosofia
Ambiente Arte
Cinema
Sport
Napoli
Università
Home