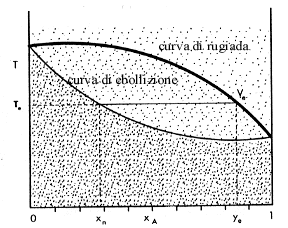
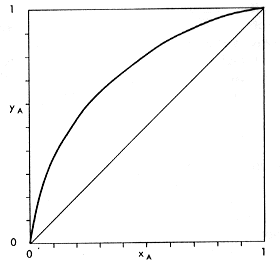
| La distillazione è un processo che consente di
separare due o più liquidi caratterizzati da punti di ebollizione
diversi. Perché avvenga la separazione è necessario portare
all'ebollizione la miscela, ottenere l'evaporazione di una parte e ricondensare
i vapori prodotti. La frazione evaporata contiene le stesse sostanze della
miscela di partenza, ma risulta arricchita dei componenti più volatili,
cioè di quelli che presentano punti di ebollizione più bassi.
La frazione che rimane allo stato liquido è più ricca dei
componenti meno volatili, cioè di quelli che hanno un punto di ebollizione
più alto. Con la distillazione teoricamente non è possibile
ottenere una sostanza assolutamente pura, in quanto da una miscela evapora
sempre una miscela e non un solo componente. La distillazione, inoltre,
è economicamente vantaggiosa solo se si devono separare liquidi
con punti di ebollizione alquanto diversi tra loro. Per comprendere la
distillazione è necessario conoscere le leggi che regolano gli equilibri
liquido-vapore nelle miscele formate da due soli liquidi completamente
miscibili tra loro in tutte le proporzioni.
Al fine di rendere più chiare le spiegazioni successive si ritiene opportuno ricordare il concetto di tensione di vapore di un liquido. |