|
LE CELLE A
COMBUSTIBILE
La nascita delle
celle a combustibile risale al 1839, anno in cui Sir
William Grove, riportò i risultati di un esperimento
nel corso del quale era riuscito a generare energia
elettrica in una cella contenente una soluzione di
acido solforico diluita, dove erano stati immersi due
elettrodi, sui quali arrivavano rispettivamente
idrogeno ed ossigeno.
Il primo utilizzo si ebbe negli anni ’60 quando furono
adottate per realizzare i generatori elettrici
nell’ambito delle missioni Gemini ed Apollo della
NASA.
CONCETTI GENERALI
La cella a
combustibile è un dispositivo che converte
direttamente l’energia chimica dei reagenti, un
combustibile ed un ossidante, in elettricità sotto
forma di corrente continua a bassa tensione,
attraverso reazioni elettrochimiche.
Il suo principio di funzionamento è assimilabile a
quello di una comune batteria, con la differenza che i
reagenti non sono immagazzinati all’interno delle
batteria ma vengono forniti dall’esterno ed inoltre né
l’elettrolita né gli elettrodi vengono consumati
durante la reazione.
La cella elementare è composta da due elettrodi in
materiale poroso rivestiti da catalizzatori immersi in
un elettrolita.
Gli elettrodi fungono da siti catalitici per le
reazioni elettrochimiche. Ad essi spetta il compito di
estrarre i prodotti di reazione dalla cella. La loro
struttura porosa facilita la diffusione dei reagenti
gassosi che alimentano la cella. Inoltre, con
l’utilizzo di opportuni catalizzatori si riesce ad
ottenere un’eccezionale cinetica chimica e quindi una
elevata densità di potenza.
L’elettrolita ha il compito di trasportare le specie
ioniche tra anodo e catodo chiudendo il circuito
elettrico all’interno della cella. Esso deve avere una
elevata conducibilità ionica ed una buona stabilità
della composizione chimica.
La più nota pila a combustibile è quella
idrogeno-ossigeno che è basata sulla combustione
fredda, cioè senza fiamma:
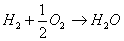 (3.1)
(3.1)
Secondo la reazione di ossidoriduzione, l’idrogeno
(combustibile) inviato all’anodo si dissocia in ioni
positivi ed elettroni; gli elettroni (e-) viaggiano
attraverso il carico esterno mentre gli ioni idrogeno
(H+) attraversano l’elettrolita migrando verso il
catodo e chiudendo cosi il circuito elettrico. Gli
ioni, al catodo, reagiscono con l’ossigeno contenuto
nell’aria producendo acqua. La trasformazione
elettrochimica è accompagnata dalla liberazione di
calore che deve essere tolto dalla cella per mantenere
costante la temperatura di funzionamento.
Una singola cella fornisce normalmente una tensione di
circa 0,7 V. Per ottenere la potenza ed il voltaggio
desiderato, più celle elementari vengono “impilate” e
unite elettricamente in serie, formando il cosiddetto
stack.
Uno degli aspetti più importanti delle celle a
combustibile sta nel fatto che l’energia chimica viene
trasformata direttamente in energia elettrica senza
essere convertita prima in energia termica come
avviene per la produzione di energia elettrica da
combustibili fossili.
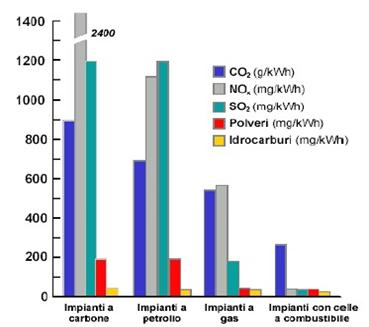
L’emissione di inquinanti, a differenza dei sistemi di
conversione tradizionali, è notevolmente ridotta. Un
confronto delle emissioni di impianti a celle
combustibile con quelle di impianti di generazione di
potenza tradizionali è riportato nella figura (3.2).
 |