|
L’IDROGENO:
CARATTERISTICHE E TECNOLOGIE DI PRODUZIONE
L’esistenza
dell’idrogeno è nota da secoli, ma la sua vera natura
iniziò ad emergere intorno al XVI secolo, quando
Paracelso descrisse per primo un’”aria infiammabile”
prodotta per reazione dell’acido solforico con il
ferro. Dopo vari studi, compiuti da diversi chimici,
si arrivò al 1783 in cui Lavoisier diede a questo gas
il nome d’idrogeno (generatore d’acqua).
CARATTERISTICHE CHIMICO-FISICHE DELL’IDROGENO
Il suo simbolo
chimico è H; è il più leggero degli elementi essendo
costituito da un solo protone ed un elettrone.
L’idrogeno naturale si presenta come una miscela di
due isotopi, cioè di specie che differiscono soltanto
per il diverso numero di neutroni presenti nel nucleo:
il protio, che ha un nucleo senza neutroni, ed il
deuterio, che ha un nucleo con un protone ed un
neutrone. Un terzo isotopo è il trizio costituito da
un nucleo con un protone e due neutroni.
La molecola dell’idrogeno è biatomica con un legame
covalente puro, cioè con una coppia d’elettroni
condivisa tra due atomi identici.
Non è presente sulla Terra allo stato libero, se non
in quantità trascurabili; questo perché l’attrazione
gravitazionale terrestre è insufficiente a trattenere
molecole molto leggere come quelle dell’idrogeno (la
sua massa volumica è 14.4 volte minore di quella
dell’aria). Si trova in abbondanza allo stato
combinato e nel campo della chimica organica sono noti
milioni di composti contenenti idrogeno che vanno dal
più semplice degli idrocarburi, il metano, alle enormi
proteine dei carboidrati con un grandissimo numero
d’atomi d’idrogeno.
A temperatura ambiente è un gas incolore ed inodore,
inoltre è insolubile in acqua. La sua reattività
chimica è limitata a temperatura ambiente mentre è
elevata ad alta temperatura o in presenza di
catalizzatori. Inoltre, esso, ha punti d’ebollizione e
di fusione più bassi d’ogni altra sostanza ad
eccezione dell’elio.
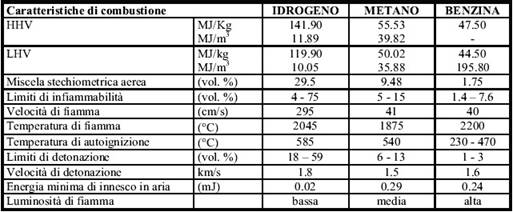
CARATTERISTICHE DI COMBUSTIONE
Tra tutti i
combustibili, l’idrogeno è quello dotato del più alto
potere calorifico. Per potere calorifico di un
combustibile si intende il calore che la sua unità di
massa o volume è in grado di produrre durante la
combustione; può essere tanto superiore che inferiore
a seconda che l’acqua proveniente dalla combustione
sia allo stato liquido o vapore.
L’idrogeno brucia facilmente e dà luogo ad emissioni
inquinanti molto inferiori agli altri combustibili.
Nella combustione in aria con fiamma libera, gli unici
prodotti inquinanti che si formano sono gli ossidi
d’azoto (NOx). Se la combustione avviene in ossigeno
puro il solo prodotto sarà acqua.
Le principali caratteristiche dell’idrogeno come
combustibile sono riportare nella tabella (1.1),
insieme a quelle del metano e della benzina per un
confronto.
VANTAGGI DELL’IDROGENO
L’idrogeno può
essere prodotto da qualsiasi fonte d’energia, comprese
quelle rinnovabili. Può essere prodotto per mezzo
d’elettricità e può essere convertito in elettricità
con rese abbastanza alte.
La materia prima fondamentale per la sua produzione è
l’acqua che è disponibile in abbondanza. L’idrogeno è
una fonte rinnovabile dato che il prodotto del suo
impiego, sia tramite combustione sia attraverso
conversione elettrochimica, è acqua pura o vapore
acqueo. E’ una fonte compatibile con l’ambiente poiché
la sua produzione, il suo immagazzinaggio, trasporto e
utilizzo finale non producono nessun agente inquinante
(eccetto gli NOx se bruciato con aria) o altro effetto
nocivo per l’ambiente.
Può essere immagazzinato sotto forma gassosa, liquida
o in idruri di metallo; essere trasportato attraverso
oleodotti, gasdotti o navi cisterna.
L’idrogeno, inoltre, non produce nessun gas serra, in
particolare CO2.
IMPIEGHI DELL’IDROGENO
L’utilizzo
dell’idrogeno, sia come materia prima che come
combustibile, è noto da diversi anni nel settore
industriale, abitativo e del trasporto.
In passato è stato utilizzato soprattutto per il
gonfiamento degli aerostati ma, a causa della sua
infiammabilità, che provocò gravi incidenti come
quello dell’Hindenburg nel 1937, è stato sostituito
con l’elio, poco più pesante ma non infiammabile.
In campo industriale è utilizzato come materia prima
nei processi di sintesi dell’ammoniaca,
nell’idrogenazione delle nafte, per la produzione di
metanolo e di carburanti sintetici e per la
preparazione di fertilizzanti.
Per quanto riguarda il suo impiego come combustibile,
l’idrogeno liquido in combinazione con l'ossigeno
liquido, è utilizzato da anni nei programmi spaziali
della NASA come propellente per gli Space Shuttle.
Nel settore dei trasporti, l’utilizzo dell’idrogeno è
stato sperimentato in due modi: nei motori a
combustione interna, dove avviene un normale processo
di combustione con trasformazione d’energia chimica in
energia termica e successiva conversione di calore in
lavoro; nelle celle a combustibile, che convertono
direttamente l’energia chimica dell’idrogeno in
energia elettrica impiegata per alimentare un motore
elettrico. |