REAZIONI CHIMICHE DI PRECIPITAZIONE IN PROVETTA
Scopo
Osservare alcune reazioni di precipitazione in soluzione associate a variazioni cromatiche.
In caso di reazione bilanciare la reazione che è intervenuta tra i reagenti.
Prerequisiti.
una reazione è un cambiamento di una o più sostanze nel sistema in esame. La maggior parte delle reazioni avvengono in fase fluida (liquidi e gas), mentre sono rare le reazioni tra particelle in fase solida, e in quest'ultimo caso le reazioni sono spesso lente (campo di indagine della geochimica).
Nei casi più comuni si hanno due reagenti e due prodotti che quindi possiamo indicare genericamente come
A + B → C + D oppure
nel caso di composti AB + CD → AD + BC
Bilanciamento è l'operazione svolta sulle reazioni chimiche in forma simbolica, con la quale si
bilanciano numero e tipo di atomi a sinistra e a destra della freccia così che è poi possibile svolgere
i calcoli stechiometrici. Dal punto di vista del bilanciamento le reazioni si suddividono in determinate,
indeterminate e impossibili.
Useremo nel seguito alcuni pedici abbreviazioni di stati di aggregazione ed esattamente:
(s) significa solido;
(l) significa liquido;
(g) significa gassoso;
(aq) significa sostanza sciolta in acqua.
Strumenti e materiali.
In laboratorio saranno presenti:
- provette e portaprovette;
- spruzzetta
- contagocce o pipette pasteur disponibili su richiesta.
- bottiglie con contagocce con le seguenti soluzioni:
| Formula | Nome | principali rischi chimici |
| Na2CO3 (aq) | carbonato di sodio | relativamente innocuo |
| NaOH (aq) | idrossido di sodio | corrosivo su tutte le superfici, evitare il contatto con acidi |
| NaCl (aq) | cloruro di sodio | relativamente innocuo, disidratante, se concentrato risulta corrosivo |
| KI (aq) | ioduro di potassio | relativamente innocuo, può essere irritante (sensibile alla luce) |
| FeCl3 (aq) | cloruro ferrico | irritante, se concentrato risulta corrosivo |
| NiSO4 (aq) | solfato di nichelio | irritante, velenoso per ingestione e inalazione |
| CuSO4 (aq) | solfato rameico | irritante sulla pelle, velenoso per ingestione e inalazione |
| AgNO3 (aq) | nitrato di argento | irritante, lascia macchie di argento su pelle e superfici, sensibile alla luce va conservato in recipienti scuri
Attenzione: allo stato puro i nitrati sono comburenti. |
| Pb(NO3)2 (aq) | nitrato piomboso | velenoso evitare il contatto
Attenzione: allo stato puro i nitrati sono comburenti. |
| | |
Aspetto ad una prima osservazione
Na2CO3 (aq) soluzione incolore
NaOH (aq) soluzione incolore
NaCl (aq) soluzione incolore
KI (aq) soluzione incolore, col tempo tende a ingiallirsi soprattuto se esposto alla luce o all'aria
FeCl3 (aq) sospensione arancio, presenta facilmente un fondo costituito da ossido ferrico.
NiSO4 (aq) soluzione verdina
CuSO4 (aq) soluzione celeste, col tempo diventa torbida
AgNO3 (aq) soluzione incolore conservata in bottiglia di vetro scura (vedi rischi chimici)
Pb(NO3) 2 (aq) soluzione incolore
Procedimento.
Operiamo in laboratorio con una serie di reazioni tra due reagenti come segue: in una provetta
pulita aggiungiamo tre quattro gocce del primo reagente, un dito di acqua (circa 2 mL) e altre
tre-quattro gocce del secondo reagente. In questa esperienza ti tipo qualitativo non ha particolare
importanza l'ordine dei due reagenti possiamo quindi dire che si osserva una proprietà "commutativa".
Tabella delle osservazioni.
In ordine di numero atomico del metallo presente nella sostanza. La sequenza risulta quindi Na, K,
Fe, Ni, Cu, Ag, Pb.
Quando esistono due parti della sostanza chimicamente simili non si prevedono
reazioni chimiche, per esempio:
Na2CO3 + NaOH → nessuna reazione
NiSO4 + CuSO4 → nessuna reazione
NaCl + FeCl3 → nessuna reazione
| | Na2CO3 | NaOH | NaCl | KI | FeCl3 | NiSO4 | CuSO4 | AgNO3 | Pb(NO3)2 |
|
| Na2CO3 | X | nulla | nulla | nulla | reazione | reazione | reazione | reazione | reazione |
| NaOH | nulla | X | nulla | nulla | reazione | reazione | reazione | reazione | reazione |
| NaCl | nulla | nulla | X | nulla | nulla | nulla | nulla | reazione | reazione |
| KI | nulla | nulla | nulla | X | nulla | nulla | reazione | reazione | reazione |
| FeCl3 | reazione | reazione | nulla | nulla | X | nulla | nulla | reazione | reazione |
| NiSO4 | reazione | reazione | nulla | nulla | nulla | X | nulla | nulla * | reazione |
| CuSO4 | reazione | reazione | nulla | reazione | nulla | nulla | X | nulla * | reazione |
| AgNO3 | reazione | reazione | reazione | reazione | reazione | nulla * | nulla * | X | nulla |
| Pb(NO3)2 | reazione | reazione | reazione | reazione | reazione | reazione | reazione | nulla | X |
Risultati.
FeCl3 (aq) + Na2CO3 (aq) —» NaCl + Fe2(CO3)3 (s) reazione solo teorica
in realtà 2 FeCl3 (aq) + 3 Na2CO3 (aq) + 12 H2O —» 6 NaCl (aq) + 3 H2CO3 (aq) + 2 Fe(OH)3 (s) ↓ precipitato arancio fioccoso
FeCl3 (aq) + NaOH (aq)—» NaCl + Fe(OH)3 (s) ↓ precipitato arancio fioccoso
NiSO4 (aq) + Na2CO3 (aq) —» Na2SO4 (aq) + NiCO3 (s) ↓ precipitato verdino reazione solo teorica
in realtà NiSO4 (aq) + Na2CO3 (aq) + 2 H2O —» NaHSO4 (aq) + NaHCO3 (aq) + Ni(OH)2 (s) ↓ precipitato fioccoso verde pomo
NiSO4 (aq) + NaOH(aq) → Na2SO4 (aq) + Ni(OH)2 (s) —» precipitato fioccoso verde pomo
CuSO4 (aq) + Na2CO3 (aq) → Na2SO4 (aq) + CuCO3 (s) —» reazione solo teorica
in realtà la reazione più veloce è CuSO4 + Na2CO3 + 2 H2O —» NaHSO4 + NaHCO3 + Cu(OH)2 (s) ↓ precipitato blu fioccoso (deposito azzurro scuro).
Col tempo deposita ossido rameico CuO marrone scudo secondo la reazione Cu(OH)2 (s) —» H2O + CuO (s) ↓ sottoreazione che non sembra avvenire stranamente nel caso della reazione successiva (tra solfato rameico e idrossido di sodio).
Vi è una seconda reazione lenta (campo della geochimica) 2 CuSO4 + Na2CO3 + 2 H2O —» 2 NaHSO4 + CuCO3•Cu(OH)2 ↓ precipitato verde-malachite
CuSO4 (aq) + NaOH —» Na2SO4 (aq) + Cu(OH)2 (s) ↓ precipitato blu fioccoso (deposito azzurro scuro)
CuSO4 (aq) + KI (aq) —» K2SO4 (aq) + CuI2 (s) —» reazione solo teorica
in realtà (nel tempo di 30 secondi) 2 CuSO4 (aq) + 4 KI(aq) —» 2 K2SO4 (aq) + I2 (aq)
+ 2 CuI(s) ↓ precipitato bianco di CuI e soluzione arancio/marrone per la presenza di I2 (aq) in acqua
vedi: https://marcocapponi.blogspot.com/2016/07/ioduro-di-rame.html?m=0
AgNO3 (aq) + Na2CO3 (aq) —» NaNO3 (aq) + Ag2CO3 (s) ↓ precipitato marroncino.
AgNO3 (aq) + NaOH (aq) —» NaNO3 (aq) + AgOH ↓ precipitato bianco o bianco sporco
AgNO3 (aq) + NaCl (aq) —» NaNO3 (aq) + AgCl(s) ↓ precipitato bianco
AgNO3 (aq) + KI (aq) —» KNO3 (aq) + AgI(s) ↓ precipitato giallino
AgNO3 (aq) + FeCl3 (aq) —» Fe(NO3)3 (aq) + AgCl(s) ↓ precipitato bianco
AgNO3 (aq) + NiSO4 (aq) —» nessuna reazione
in realtà solo con soluzioni concentrate AgNO3 (aq) + NiSO4 (aq) —» Ni(NO3)2 (aq) + Ag2SO4 (s) ↓ precipitato bianco
AgNO3 (aq) + CuSO4 (aq) —» nessuna reazione
in realtà solo con soluzioni concentrate AgNO3 (aq) + CuSO4 (aq) —» Cu(NO3)2 (aq) + Ag2SO4 (s) ↓ precipitato bianco
Pb(NO3)2 (aq) + Na2CO3 (aq) —» NaNO3 (aq) + PbCO3 (s) ↓ reazione solo teorica
in realtà Pb(NO3)2 (aq) + Na2CO3 (aq) + H2O —» 2 NaNO3 (aq) + H2CO3 (aq) + Pb(OH)2 (s) ↓ precipitato bianco lattiginoso
Pb(NO3)2 (aq) + NaOH —» NaNO3 (aq) + Pb(OH)2 (s) ↓ precipitato bianco lattiginoso
(reazione variabile con la concentrazione dei reagenti)
Pb(NO3)2 (aq) + NaCl (aq)—» NaNO3 (aq) + PbCl2 (s) ↓ precipitato bianco
Pb(NO3)2 (aq) + KI (aq) —» KNO3 (aq) + PbI2 (s) ↓ precipitato giallo dorato a scaglie
Pb(NO3)2 (aq) + FeCl3 (aq) —» Fe(NO3)3 (aq) + PbCl2 (s) ↓ precipitato bianco
Pb(NO3)2 (aq) + CuSO4 (aq) —» Cu(NO3)2 (aq) + PbSO4 (s) ↓ precipitato bianco
Pb(NO3)2 (aq) + NiSO4 (aq) —» Ni(NO3)2 (aq) + PbSO4 (s) ↓ precipitato bianco
Alcune foto.
Nella seguente foto  in successione i precipitati
1) PbI2 (s); 2) CuI2 [in realtà I2 (aq) + CuI(s)];
3) CuCO3 (s) [in realtà Cu(OH)2 (s)]; 4) Cu(OH)2 (s);
5) Ag2SO4 (aq); 6) Fe2(CO3)3 (s)
[in realtà Fe(OH)3 (s)]. in successione i precipitati
1) PbI2 (s); 2) CuI2 [in realtà I2 (aq) + CuI(s)];
3) CuCO3 (s) [in realtà Cu(OH)2 (s)]; 4) Cu(OH)2 (s);
5) Ag2SO4 (aq); 6) Fe2(CO3)3 (s)
[in realtà Fe(OH)3 (s)].
Nella seguente foto 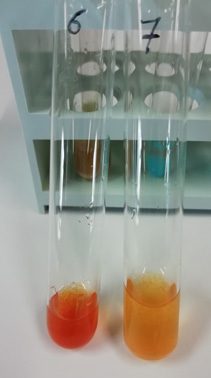 si confrontano i risultati delle due prove
6) Fe2(CO3)3 (s) [in realtà Fe(OH)3 (s)]
e 7) Fe(OH)3 (s),
per diluizione della 6) si ottiene la medesima colorazione della 7). si confrontano i risultati delle due prove
6) Fe2(CO3)3 (s) [in realtà Fe(OH)3 (s)]
e 7) Fe(OH)3 (s),
per diluizione della 6) si ottiene la medesima colorazione della 7).
Nella seguente foto  si confrontano i risultati delle due prove
8) NiCO3 (s) e 9) Ni(OH)2 (s) molto simili, forse entrambe
da identificare con idrossido di nichelio. si confrontano i risultati delle due prove
8) NiCO3 (s) e 9) Ni(OH)2 (s) molto simili, forse entrambe
da identificare con idrossido di nichelio.
Commento ai risultati.
Come si può notare dalla sequenza delle varie considerazioni prese in esame per ogni
singola reazione, sebbene sia teoricamente facile osservare una reazione che interviene in un
sistema, analizzando il risultato non sempre è possibile discriminare che tipo di reazione è
intervenuta.
- In ambiente acido dobbiamo infatti considerare presente in soluzione acquosa anche la specie
chimica H+ (o H9O4+).
- In ambiente basico dobbiamo infatti considerare presente in soluzione acquosa anche la specie
chimica OH- (o H9O5-).
Dovremo inoltre eseguire la prova sia con reagenti diluiti, che con reagenti concentrati, per
comparare i diversi tipi di prodotti ottenuti e quindi considerare nelle nostre indagini sia
la reattività da un punto di vista "regolare" cioé quello di una classica reazione
di doppio scambio, sia una reattività "irregolare" tenendo in considerazione che il tipo di
prodotto varia al variare della concentrazione dei reagenti (principio di Berthollet) o che si
possono avere delle reazioni, diciamo per ora impreviste, del tipo di ossido-riduzioni.
Conclusioni.
Si sono eseguite una serie di reazioni tra due composti chimici entrambi in soluzione osservando
in alcuni casi un semplice mescolamento e in altri casi una reazione chimica con formazione di un
precipitato, ossia una reazione di precipitazione.
Come indicato risultati non è sempre facile identificare la reazione o il prodotto formato
nel corso della reazione dovendo tenere in considerazione vari fattori: sistema acido o basico,
concentrazione, cambi di valenza e reazioni di ossido-riduzione.
|
 in successione i precipitati
1) PbI2 (s); 2) CuI2 [in realtà I2 (aq) + CuI(s)];
3) CuCO3 (s) [in realtà Cu(OH)2 (s)]; 4) Cu(OH)2 (s);
5) Ag2SO4 (aq); 6) Fe2(CO3)3 (s)
[in realtà Fe(OH)3 (s)].
in successione i precipitati
1) PbI2 (s); 2) CuI2 [in realtà I2 (aq) + CuI(s)];
3) CuCO3 (s) [in realtà Cu(OH)2 (s)]; 4) Cu(OH)2 (s);
5) Ag2SO4 (aq); 6) Fe2(CO3)3 (s)
[in realtà Fe(OH)3 (s)].
 si confrontano i risultati delle due prove
6) Fe2(CO3)3 (s) [in realtà Fe(OH)3 (s)]
e 7) Fe(OH)3 (s),
per diluizione della 6) si ottiene la medesima colorazione della 7).
si confrontano i risultati delle due prove
6) Fe2(CO3)3 (s) [in realtà Fe(OH)3 (s)]
e 7) Fe(OH)3 (s),
per diluizione della 6) si ottiene la medesima colorazione della 7).
 si confrontano i risultati delle due prove
8) NiCO3 (s) e 9) Ni(OH)2 (s) molto simili, forse entrambe
da identificare con idrossido di nichelio.
si confrontano i risultati delle due prove
8) NiCO3 (s) e 9) Ni(OH)2 (s) molto simili, forse entrambe
da identificare con idrossido di nichelio.

