RISCALDAMENTO DELL'ACQUA
Risulta una semplice esercitazione per 'impratichirsi' con l'attrezzatura del laboratorio e fare un primo grafico
cartesiano molto semplice.
Prerequisiti.
L'acqua è un liquido che sebbene contenga generalmente sali disciolti la loro concentrazione è
tale da potersi considerare, la maggior parte delle volte, praticamente pura. Se la consideriamo
una sostanza pura quindi, è possibile analizzare e dedurre conclusioni sui processi fisici di
cambiamenti di stato (di aggregazione).
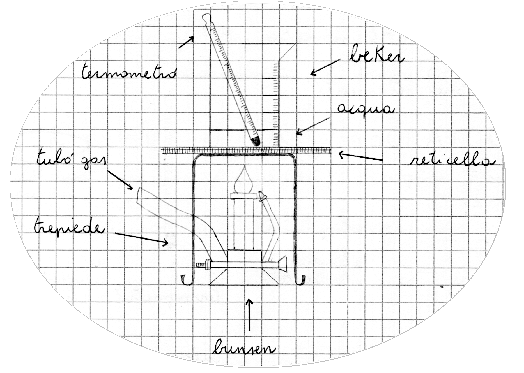
Attrezzatura e Strumenti.
In laboratorio saranno presenti:
- treppiede;
- becher medio;
- un termometro;
- becco Bunsen;
- reticella;
- cronometro;
- cilindro graduato.
Procedimento
Si preleva acqua dal rubinetto del proprio bancone e si riempie così un becher da 100 ml.
Si versa parte dell'acqua nel cilindro e si porta a volume (40 ml) utilizzando un contagocce.
Si versa l'acqua in un becher da 400 ml.
Si accende il becco Bunsen con fiamma moderata.
Si inserisce il termometro e si fa partire il cronometro.
Su un foglio si registrano temperature ed i tempi relativi.
All'ebollizione si toglie il termometro dal sistema.
Si attende la fine dell'ebollizione e si registra il tempo complessivo.
Osservazioni
Si osserva il processo fisico H2O (l) + calore —» H2O (g)
Non è così semplice distinguere l'inizio dell'ebollizione poiché il processo di intensa evaporazione -
ebollizione non è sempre netto.
Il termometro segna diverse temperature a seconda di quanto è bagnato il bulbo alla base dello strumento.
pericoli e precauzioni
Particolare cura si deve prestare quando si misurano le temperature, il vapore si trova a 100 °C ed è facile
scottarsi. Alla fine della prova lasciar raffreddare il becher prima di lavarlo.
Risultati
Dalla tabella dati seguente:
| tempo in hh:mm:ss | secondi | Temperatura in °C |
| 11:15:15 | 0 | 24 |
| 11:15:35 | 20 | 35 |
| 11:15:55 | 40 | 43 |
| 11:16:25 | 70 | 50 |
| 11:16:45 | 90 | 63 |
| 11:17:10 | 115 | 73 |
| 11:17:35 | 140 | 81 |
| 11:18:05 | 170 | 89 |
| 11:18:35 | 200 | 95 |
| 11:18:50 | 215 | 98 |
| 11:19:00 | 230 | 99 |
| 11:19:30 | 250 | 100 |
| ... | ... | 100 |
| 11:34:30 | 1155 | fine eboll. |
Si può ottenere il seguente grafico cartesiano.
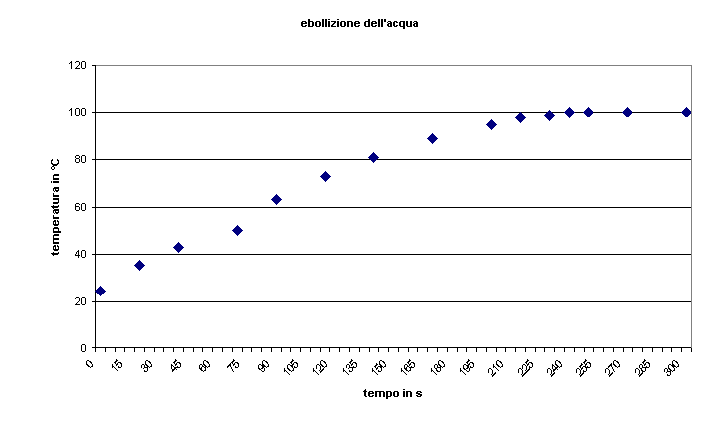 Si nota la regolarità con cui il riscaldamento procede, praticamente una retta che 'si curva'
in corrispondenza dell'ebollizione dell'acqua. Il calore ricevuto viene quindi utilizzato dal
sistema non più per aumentare la temperatura ma per 'trasformare' le molecole di acqua da liquide
a gassose.
Si nota la regolarità con cui il riscaldamento procede, praticamente una retta che 'si curva'
in corrispondenza dell'ebollizione dell'acqua. Il calore ricevuto viene quindi utilizzato dal
sistema non più per aumentare la temperatura ma per 'trasformare' le molecole di acqua da liquide
a gassose.
Si nota una difformità del 4 punto del grafico dovuta probabilmente ad uno scarso tempismo lettura
- tempo sull'orologio causata dal fatto che il singolo operatore doveva effettuare entrambe le
letture in un tempo piuttosto rapido e senza scottarsi.
Il tempo totale per arrivare alla fine dell'ebollizione dei 40 ml di acqua risulta 19'15" (pari a
1155 s).
Un mio studente, Camurani Mattia, che ha eseguito un riscaldamento più lento ha ottenuto il seguente
grafico

Conclusioni
La prova è stata portata a termine con successo nei termini previsti dal tempo a disposizione (circa 25 minuti).
All'ebollizione la temperatura rimane pressoché costante (98-99°C a seconda della posizione del termometro).
Approfondimenti
Bisogna sottolineare la differenza esistente tra evaporazione che avviene gradualmente durante
tutto l'intervallo di temperatura, soprattutto verso le temperature più alte con formazione di
aloni temporanei sulle pareti del becher e l'ebollizione che è il vero e proprio passaggio di
stato caratterizzato da una più o meno intensa formazione di bolle di vapore all'interno della
massa liquida soggetta a riscaldamento.
Ringraziamenti
Il disegno riportato ed il secondo grafico sono dello studente Camurani Mattia (a.s. 2009/2010).
Si ringraziano anche tutti i ragazzi che hanno eseguito l'esercitazione ed il prof. Angelini Andrea.
|