A caldo molti ossiacidi possono perdere nuovamente le molecole di acqua e quindi tornare
allo stato di anidridi che possono essere conservate a patto che il recipiente sia ben sigillato.
Molte anidridi d'altro canto risultano igroscopiche e quindi, in condizioni di temperatura
e pressione normali, assorbono spontaneamente l'acqua dall'atmosfera agendo come disidratanti e
trasformadosi in acidi. Per esempio l'anidride fosforica:
P2O5 + 3 H2O —» 2 H3PO4
Le loro formule di strutture non risultano sempre facili da disegnare, si seguono le seguenti
regole utili.
| ossiacidi ternari | valenza
non-metallo | formula chimica | formula di struttura |
Acido metaborico
IUPAC = biossiborato di idrogeno | III | HBO2 | 
Esercizio |
Acido (orto) borico
IUPAC = triossiborato di tri-idrogeno | III | H3BO3 | 
struttura classica |
Acido (tetra) borico
IUPAC = eptaossissiborato di di-idrogeno | III e IV | H4B2O7•2 H2O
H2B4O5(OH)4 | 
Esercizio |
Acido Acido (meta) carbonico
IUPAC = triossicarbonato di di-idrogeno | IV | H2CO3 | 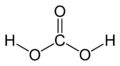
struttura classica |
Acido nitroso
IUPAC = biossinitrato di idrogeno | III | HNO2 | 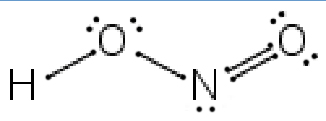
struttura di Lewis |
Acido mitrico
IUPAC = triossinitrato di idrogeno | V | HNO3 | 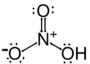
struttura di Lewis che segue
la regola dell'ottetto |
Acido (ipo) fluoroso
IUPAC = ossifluorato di idrogeno | V | HFO | 
Esercizio |
Acido metaalluminico
IUPAC = biossialluminato di idrogeno | III | HAlO2 | 
Esercizio |
Acido (orto) silicico
IUPAC = tetraossisilicato di tetra-idrogeno | IV | H4SiO4 | 
Esercizio |
altri acidi del silicio
acido ciclotrisilicico
acido ciclootetrasilicico
acido cicloesasilicico
acido inodisilicico
acido inotetrasilicico
acido fillodisilicico | IV |
H6Si3O9
H8Si4O12
H12Si6O18
H4Si2O6
H6Si4O11
H2Si2O5
| 
Esercizio |
Acido ipofosforoso (fosfinico)
IUPAC = biossifosfato di tri-idrogeno | III o V | H3PO2 | 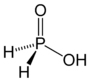
struttura classica |
Acido fosforoso (fosfonico)
IUPAC = triossifosfato di tri-idrogeno | III o V | H3PO3 | 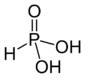
struttura classica |
Acido (orto)fosforico
IUPAC = tetraossifosfato di tri-idrogeno | V | H3PO4 | 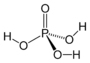
struttura classica |
Acido (piro)fosforico
IUPAC = eptaossifosfato di tetra-idrogeno | V | H4P2O7 | 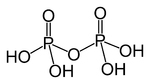
struttura classica |
Acido solforoso
IUPAC = triossisolfato di bi-idrogeno | IV | H2SO3 | 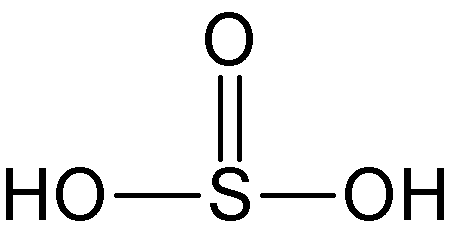
struttura classica |
Acido solforico
IUPAC = tetraossisolfato di bi-idrogeno | VI | H2SO4 | 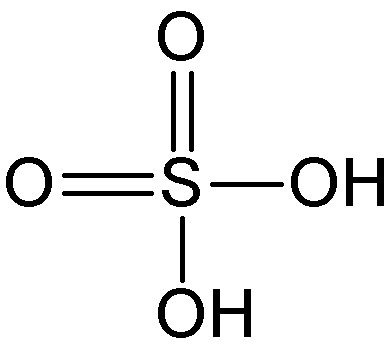
struttura classica |
Acido ipocloroso
IUPAC = ossiclorato di idrogeno | I | HClO | 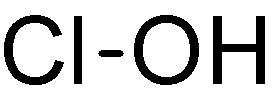
struttura classica |
Acido cloroso
IUPAC = biossiclorato di idrogeno | III | HClO2 | 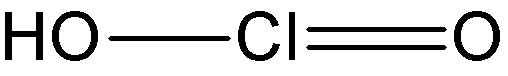
struttura classica |
Acido clorico
IUPAC = triossiclorato di idrogeno | V | HClO3 | 
struttura classica |
Acido perclorico
IUPAC = tetraossiclorato di idrogeno | VII | HClO4 | 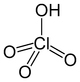
struttura classica |
Acido cromico
IUPAC = tetraossicromato di bi-idrogeno | VI | H2CrO4 | 
Esercizio |
Acido dicromico (pirocromato)
IUPAC = eptaossicromato di bi-idrogeno | VI | H2CrO7 | 
Esercizio |
Acido Acido manganico
IUPAC = tetraossimanganato di bi-idrogeno | VI | H2MnO4 | 
Esercizio |
Acido permanganico
IUPAC = tetraossimanganato di idrogeno | VII | HMnO4 | 
Esercizio |
Acido (ipotetico) ferrico
IUPAC = tetraossiferrato di bi-idrogeno | VI | H2FeO4 | 
Esercizio |
Acido Acido iodico
IUPAC = triossiiodato di idrogeno | V | HIO3 | 
Esercizio |
Acido Acido xenico
IUPAC = triossixenato di bi-idrogeno | V | H2XeO3 | 
Esercizio |
| ossiacidi quaternari | valenza
del carbonio | formula chimica | formula di struttura |
Acido cianico
IUPAC = cianato di idrogeno | IV | HOCN | 
Esercizio |
Acido Acido isocianico
IUPAC = isocianato di idrogeno | IV | HNCO | 
Esercizio |
Acido Acido fulminico
IUPAC = fulminato di idrogeno | IV o II | HCNO o HONC | 
Esercizio |
Acido rodanidrico o Acido tiocianico
IUPAC = tiocianato di idrogeno | IV | HSCN | 
Esercizio |
| ossiacidi quintinari | valenza
dello zolfo | formula chimica | formula di struttura |
| Acido iporodanoso | II | HOSCN | 
Esercizio |
| Acido rodanoso | IV | HOSOCN | 
Esercizio |
| Acido rodanico | VI | HOSO2CN | 
Esercizio |
| Acido (ipotetico) perrodanico | VI | HOSO2CNO o HOSO2OCN | 
Esercizio |