Luminescenza dell'ossigeno in stato di singoletto
Prima della descrizione dell'esperimento è doveroso uno speciale ringraziamento a Patrizia Leonardi senza il cui appoggio sarebbe stato impossibile l'esecuzione di questo bello esperimento.
Le molecole possono ruotare, vibrare ed anche eccitarsi. Le molecole allo stato eccitato hanno proprietà fisiche
e chmiche completamente differenti da quelle originarie tanto che sì possono considerare come una specie di
isomeri instabili.
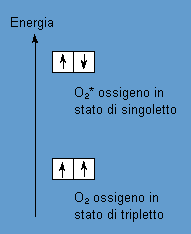 Uno degli esempi più "visibili" dell'eccitazione delle molecole
è il caso dell'ossigeno O2: esso esiste in natura in una molecola biatomica che possiede due elettroni
spaiati (ossia è una molecola biradicalica) che si possono disporre in diverse maniere negli orbitali
liberi a disposizione.
La forma a più bassa energia ha gli spin dei due elettroni dello stesso segno (regola di Hund)
e la molecola possiede una molteplicità di tripletto; una forma diversa dell'ossigeno ha gli spin dei due
elettroni di segno diverso che contraddistingue la molecola nello stato di singoletto. Uno degli esempi più "visibili" dell'eccitazione delle molecole
è il caso dell'ossigeno O2: esso esiste in natura in una molecola biatomica che possiede due elettroni
spaiati (ossia è una molecola biradicalica) che si possono disporre in diverse maniere negli orbitali
liberi a disposizione.
La forma a più bassa energia ha gli spin dei due elettroni dello stesso segno (regola di Hund)
e la molecola possiede una molteplicità di tripletto; una forma diversa dell'ossigeno ha gli spin dei due
elettroni di segno diverso che contraddistingue la molecola nello stato di singoletto.
MaterialePer questo esperimento sono necessari:
- idrossido di sodio
- acqua distillata
- acqua ossigenata o perossido di idrogeno al 30%
- cloro gassoso in bombola oppure due soluzioni di acido cloridrico e ipoclorito di sodio da mescolarsi
al momento dell'esperimento
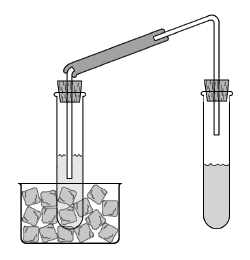
Procedimento
In un provettone si mescolano una soluzione circa al 15% di idrossido (30 ml) di sodio con una di perossido di
idrogeno al 30% (7 ml) e si raffredda con un bagno di ghiaccio.
Si sistema quindi la vetreria come rappresentata in figura e si prepara nell'altro provettone una soluzione al
13% di ipoclorito di sodio o potassio. Quando si è pronti si aggiunge a quest'ultima soluzione acido cloridico
concentrato e immediatamente si chiude il sistema, non si dovrebbero osservare grandi variazioni termiche.
Il cloro prodotto a destra migra quindi per variazione di pressione nel provettone di sinistra dove reagisce con
la soluzione basica di perossido di dirogeno secondo la descrizione sotto riportata.
La luminescenza sarà palese solo dopo un breve intervallo di tempo sotto forma di bolle rossiccie che se
susseguentisi velocemente creano un effetto simile ad una fiammata. Se si opera con soluzioni diluite l'effetto
visivo è molto inferiore ma ancora osservabile, con un tempo di induzione maggiore.
DescrizioneLa serie di reazioni che avviene è la seguente: nel sistema di destra si genera
cloro gassoso mediante la reazione:
NaClO + HCl —» Cl2 (g) + NaCl (aq/s)
Il cloro passa poi nel sistema di sinistra dove reagisce in soluzione basica di perossido di idrogeno formando
le seguenti speci chimiche:
Cl2 (g) + OH- (aq) —» HClO (aq) + Cl-(aq)
HClO (aq) + H2O2 (aq) —» HOOCl (aq) + H2O (aq)
HOOCl + OH- (aq) —» H2O (aq) + Cl- (aq) + O2* (aq)
In base al principio di conservazione dello spin, si forma ossigeno allo stato eccitato di singoletto, non di tripletto. Dove abbiamo indicato con un asterisco una specie chimicamente eccitata. L'ossigeno tende a convertirsi nella forma più stabile (diseccitata) di tripletto, processo che è accompagnato dall'emissione di energia sotto forma di un fotone luminoso.
L'ossigeno è solubile in acqua motivo per cui la reazione si osserva in fase liquida e non in fase gassosa.
O2*(aq) —» O2 (aq/g) + hv
Nella fattispecie la radiazione emessa (delta energetico hv) è a circa 700 nm ed è di colore rosso,
in tutto simile al colore di una fiamma prodotta dal fuoco.
Eliminazione dei residui
La soluzione clorogena, si diluisce e si elimina nel lavandino (è un ottino disinfettante), fare attenzione
ai gas di cloro che sono estremamente tossici, aereare il sistema. Il precipitato eventualmente presente era
cloruro di sodio che quindi si solubilizza appena viene diluito.
La soluzione basica si neutralizza con acido solforico e viene al pari versata nello scarico.
Bibliografia
Herbert Walter Roesky e Klaus Mockel "Il luna park della chimica" Zanichelli 1998
Claudio Guardigli "appunti di lezione di fotochimica" del Prof. Balzani Bologna, anno accademico 1993/1994
|