![]() Home page
Home page ![]() torna
al menu quarte classi
torna
al menu quarte classi
APPUNTI DI TERMODINAMICA
La Termodinamica studia il bilancio energetico di un fenomeno.
In particolare la Termodinamica
chimica studia il bilancio energetico dei fenomeni chimici e cioè la
differenza fra il contenuto energetico del sistema chimico prima e dopo la
reazione, cioè fra gli stati iniziale e finale, ignorando il particolare
percorso che esso effettua (oggetto di studio della cinetica chimica).
Studiare il bilancio
energetico di un fenomeno significa individuare e quantificare i modi di
trasferimento dell’energia. Il LAVORO
è un modo di trasferimento di energia che ha luogo quando le parti di un
sistema si muovono sotto l’azione di forze esterne. Il CALORE è un modo di trasferimento di energia che può avvenire
quando due sistemi aventi diverse temperature vengono posti in contatto. E’
importante sottolineare che calore e lavoro non vanno intesi come “forme di
energia”, ma bensì come modi di
trasferimento dell’energia. Infatti, mentre possiamo definire “l’energia di
un sistema”, non è altrettanto lecito parlare di “calore di un sistema” o di
“lavoro di un sistema”.
Un sistema si definisce aperto se può scambiare energia
e materia con l’ambiente circostante. Esso si definisce chiuso se può scambiare solo energia.
Si definisce isolato se non può
scambiare né energia, né materia.
Per convenzione assegneremo il segno positivo al
lavoro (w) che viene compiuto sul sistema e al calore (q) che entra nel
sistema, mentre assegneremo il segno negativo al lavoro fatto dal sistema e al
calore che esce dal sistema.
Primo principio della termodinamica
Ogni sistema è
caratterizzato da una quantità di energia, chiamata ENERGIA INTERNA (U), che rappresenta la somma di tutte
le forme di energia possedute dai suoi costituenti (molecole). Per un sistema
ideale e chiuso, ad esempio un gas ideale posto in un recipiente chiuso, U
dipende solo dalla temperatura. L’energia interna U gode della proprietà che se
il sistema subisce una trasformazione passando dallo stato 1, a cui corrisponde il valore U1, allo stato 2, a cui corrisponde il valore U2,
la sua variazione
DU= U2-
U1 (1)
è indipendente
dal particolare tipo di trasformazione, cioè dal particolare cammino
percorso dal sistema per portarsi dallo stato 1 a quello 2. Grandezze
di questo tipo vengono chiamate funzioni
di stato. Ora, se i soli modi di trasferimento dell’energia in un
sistema durante una trasformazione sono il calore e il lavoro si può indicare
la variazione di energia interna come
DU= q + w (2)
dove i segni di q e di w sono presi secondo le
convenzioni sopra illustrate. Mentre le quantità di calore e di lavoro variano
a seconda del particolare cammino che conduce il sistema dallo stato iniziale a
quello finale, tuttavia la loro somma algebrica deve corrispondere sempre alla
variazione di energia interna tra lo stato iniziale quello finale. La (2)
dunque esprime la prima legge della
termodinamica. Essa rappresenta un’estensione del principio di
conservazione dell’energia alla termodinamica, poiché contempla anche il calore
come modo di trasferimento di energia. Perciò essa stabilisce l’impossibilità
del moto perpetuo, cioè l’impossibilità di costruire una macchina che produca
energia o lavoro utile dal nulla.
trasformazioni
reversibili e irreversibili. Processi isotermi e adiabatici
Una trasformazione si dice reversibile se il sistema, passando dallo stato iniziale a
quello finale, percorre una serie grandissima di stadi di equilibrio
caratterizzati da variazioni piccolissime delle variabili di stato. E’ invece irreversibile se, a causa di
variazioni grossolane e repentine delle variabili di stato, il sistema passa
dallo stato iniziale a quello finale in condizioni di non equilibrio. E’
importante sottolineare che mentre in una trasformazione reversibile è
possibile stabilire e conoscere le relazioni funzionali tra le variabili, e
quindi definire delle leggi di stato, in quelle irreversibili ciò non è
possibile.
Un processo si definisce isotermo se avviene a
temperatura costante. Per realizzare il più da vicino le condizioni isotermiche
si suole spesso far avvenire le reazioni in opportuni termostati.
Un processo è adiabatico
se avviene senza scambio di calore con l’ambiente. Ci si può avvicinare alle
condizioni adiabatiche mediante un accurato isolamento termico, il miglior modo
per realizzare il quale consiste nel circondare il sistema con un’intercapedine
a vuoto spinto e nel ridurre al minimo le perdite dovute all’irraggiamento con
l’uso di pareti molto lucide. Un’applicazione di tali principi si ha nella
costruzione dei vasi Dewar.
ENTALPIA
Durante un processo condotto a volume costante non
viene eseguito alcun lavoro meccanico. Ne consegue che l’aumento in energia
interna eguaglia il calore assorbito a volume costante:
DU= qv (3)
Consideriamo una trasformazione
nella quale l’unica forma di lavoro prodotto dal sistema in una trasformazione
reversibile è una espansione contro una pressione P. Se la pressione è
mantenuta costante, per esempio in esperienze condotte a pressione atmosferica,
e non viene fatto altro lavoro che P×DV, si ha:
DU= U2- U1= q + w= q - P×(V2-V1) da cui
q =U2- U1 + P×(V2-V1)
e quindi, raggruppando i termini con gli stessi indici,
(U2+ P×V2) - (U1+ P×V1)= qp (4)
dove qp
è il calore assorbito a pressione costante. In tal modo viene definita una
nuova funzione, l’ ENTALPIA:
H=U +PV (5)
quindi la (4) diventa
DH= H2-H1= qp (6)
L’aumento di entalpia è
uguale al calore assorbito a pressione costante quando non viene fatto altro
lavoro che P×DV. Poiché U, V e P sono tutte funzioni di
stato, anche l’entalpia, che viene definita in termini di queste funzioni, è
una funzione solamente dello stato del sistema, cioè indipendente dal cammino
secondo il quale tale stato è raggiunto.
CAPACITA’ TERMICA E CALORE SPECIFICO
La capacità termica di una sostanza è il rapporto tra la quantità di
calore fornita o ceduta ad essa e la corrispondente variazione di temperatura:
C= Dq/DT
Il calore specifico è la capacità termica dell’unità di massa (mole).
Le capacità termiche a
volume costante e rispettivamente a pressione costante sono, per quanto già
detto:
CV= qV/DT= DU/DT
e
Cp= qp/DT= DH/DT
Di solito Cp è maggiore di Cv, in quanto a pressione costante
una parte del calore assorbito da una sostanza viene impiegato come lavoro di
espansione, mentre a volume costante la totalità del calore si traduce in
aumento della temperatura (e quindi di energia interna). In particolare, per un gas ideale si può
dimostrare che Cp - CV =nR (7)
dove n è il numero di
moli della sostanza e R è la costante universale dei gas.
TERMOCHIMICA - CALORI DI REAZIONE
La termochimica è lo studio
degli effetti termici legati ai processi chimici, alla formazione di soluzioni,
e a variazioni di stato di aggregazione quali la fusione o l’evaporazione. I
processi chimico-fisici si possono classificare in endotermici quando comportano assorbimento
di calore, e esotermici quando sono
accompagnati da sviluppo di calore.
Come ogni altro
trasferimento di calore, il calore di una reazione chimica dipende dalle
condizioni del processo dal quale esso è prodotto.
Due particolari condizioni sono importanti perché comportano calori di reazione
uguali a variazione di funzioni termodinamiche.
La prima di queste è la
condizione di volume costante. Se il
volume di un sistema è mantenuto costante, non viene fatto lavoro sul sistema
(supponendo che l’unico lavoro possibile nelle date condizioni sperimentali sia
quello di volume). L’equazione (2) della prima legge della termodinamica
diventa allora:
DU= qv (8)
Cioè il calore di reazione
misurato a volume costante è esattamente uguale alla variazione di energia
interna DU del sistema che reagisce.
Questa condizione è rispettata nel modo migliore quando si fa avvenire la
reazione in una bomba calorimetrica.
L’altra importante
condizione particolare è quella a pressione
costante. Durante gli esperimenti fatti nelle ordinarie condizioni di
laboratorio la pressione è effettivamente costante. Molti calorimetri operano a pressione atmosferica. In questo caso
possiamo scrivere, come nell’equazione (6),
DH= qp (9)
Cioè il calore di reazione
misurato a pressione costante è esattamente uguale alla variazione di entalpia
del sistema che reagisce.
Per definire il calore di
reazione bisogna scrivere esattamente l’equazione chimica per la reazione e
inoltre specificare gli stati dei reagenti e dei prodotti, in particolare la
temperatura alla quale si è compiuta la misura. Poiché la maggiorparte delle
reazioni viene studiata essenzialmente a pressione costante, il calore di
reazione é in genere dato dal DH. Ad esempio:
CO2(1 Atm) + H2(1 Atm) ® CO(1 Atm)
+ H2O(g, 1 Atm),
DH298= 41160 (reazione endotermica)
In base alla prima legge, DU e DH per una qualsiasi
reazione chimica sono indipendenti dal percorso seguito dal sistema nel passare
dai reagenti ai prodotti, e di conseguenza, sono anche indipendenti dalla
presenza o meno di reazioni intermedie.
Tale principio, stabilito
per la prima volta da G.H.Hess
(1840), va sotto il nome di Legge della
somma costante dei calori.
Un calore di reazione è
quindi calcolabile dai dati riguardanti reazioni chimiche del tutto diverse. Ad
esempio:
(1) COCl2 + H2S ® 2HCl + COS DH298= -78705
Joule
(2) COS + H2S ® H2O + CS2
(l) DH298=
+ 3420 Joule
![]()
(3) COCl2 + 2H2S
®
2HCl + H2O + CS2
(l) DH298=
-75285 Joule
Entalpie di formazione
Lo stato standard per una sostanza che di solito conviene assumere è
lo stato nel quale la sostanza è stabile
a 298,15 °K (25°C) e 1 Atm.
Per convenzione le entalpie degli elementi chimici in questo
particolare stato standard sono poste uguali a zero.
L’entalpia standard di formazione di un composto, DHÄf, é il DH della reazione
con la quale il composto si forma dai suoi elementi, con i reagenti e i
prodotti tutti nello stato standard.
Ad esempio, per uno stato
standard a 298,15 °K
S
+ O2 ® SO2 DHÄf 298 = - 296,9 kJ
Molte entalpie standard di
formazione sono state ottenute da misure di calori di combustione (reazioni di
ossidazione alle quali partecipa l’ossigeno). Infatti, se sono note le entalpie
standard di formazione dei prodotti della reazione di combustione di un
composto chimico, la sua entalpia standard di formazione si può calcolare dal
calore di combustione. Ad esempio,
(1) C2H6 +
7/2O2 ® 2CO2 + 3H2O(l) DHÄ 298 = - 1560,1 kJ
(2) C(grafite)
+ O2 ® CO2 DHÄf 298 = -393,5 kJ
(3) H2 + 1/2 O2 ® H2O(l)
DHÄf 298 = -285,8 kJ
![]()
(4) 2C
+ 3H2 ® C2H6 DHÄf 298 = -84,3
kJ
Per ottenere come somma la
reazione (4) e il relativo valore dell’entalpia standard di formazione, è
necessario invertire la reazione (1) di combustione (e quindi anche il segno
dell’entalpia standard di combustione), moltiplicare per 2 i coefficienti
dell’equazione (2) (e il relativo valore dell’entalpia standard di formazione,
essendo le entalpie riferite sempre ad una mole), ed infine moltiplicare per 3
i coefficienti dell’equazione (3) (e il relativo valore dell’entalpia di
formazione).
Inoltre per una reazione
generica, grazie alla Legge di Hess, la variazione di entalpia standard può
essere facilmente ricavata come differenza tra le entalpie standard di
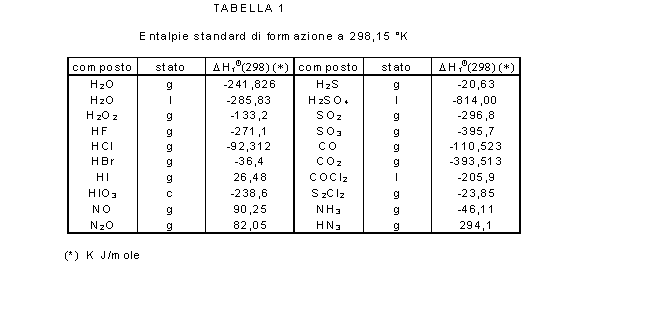
formazione dei prodotti e dei reagenti. Nella tabella sottostante sono
riportate le entalpie standard di formazione di alcuni composti:
IL SECONDO PRINCIPIO
DELLA TEMODINAMICA
La conversione del calore in
lavoro fu oggetto di grande interesse da parte degli ingegneri dal tempo dello
sviluppo della macchina a vapore ad opera di James Watt nel 1769. Una tale
macchina funziona essenzialmente così: una sorgente di calore (ad es. un fuoco
di carbone o di legna) riscalda una sostanza che lavora (ad es. il vapore) e ne
provoca l’espansione, attraverso un’opportuna valvola, in un cilindro provvisto
di un pistone. L’espansione spinge in avanti il pistone e per mezzo di un
adatto accoppiamento si può ricavare lavoro dalla macchina. La sostanza che
lavora si raffredda nell’espansione e viene espulsa dal cilindro attraverso una
valvola. Un congegno con un volano riporta il pistone alla sua posizione
iniziale, pronto per un’altra espansione.
In termini semplici, quindi,
una macchina termica riceve calore dalla sorgente termica o serbatoio caldo, ne
trasforma una parte in lavoro e cede il rimanente calore allo scarico termico o
serbatoio freddo.
Le macchine a vapore
subirono un progressivo miglioramento durante la rivoluzione industriale che si
ebbe in Inghilterra agli inizi del secolo XIX. Poiché il rapporto tra il lavoro
prodotto da una macchina e la quantità di carbone in essa bruciata aumentava
con il perfezionarsi delle tecnologie costruttive, non s’intravedeva alcun limite
per l’efficienza delle macchine, o rendimento, (e) espressa dal rapporto:
![]() (10)
(10)
dove w è il lavoro prodotto
dalla macchina (preso col segno negativo, poiché esce dal sistema) e q è il calore
fornito (positivo, poiché entra nel sistema).
Fu un ingegnere francese,
Sadi Carnot, a dimostrare che il rendimento di una macchina termica ha un
limite dipendente unicamente dalla differenza di temperatura dei due serbatoi
termici tra i quali lavora la macchina stessa e non dalle sue caratteristiche
tecniche, né tanto meno dalla natura del fluido che lavora. Egli illustrò un
modello astratto delle caratteristiche fondamentali della macchina termica
nella memorabile monografia dal titolo Rifletions
sur la Puissance Motrice du Feu.
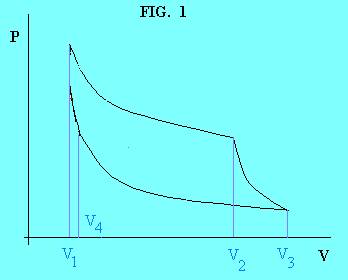
In tale modello la macchina opera tra due temperature T2
e T1, con T2> T1, ed effettua un ciclo
reversibile composto di due trasformazioni isoterme e due trasformazioni
adiabatiche (FIG. 1):

serbatoio
termico
![]() T2
T2
q2

![]()
![]() w3 MACCHINA -w1
w3 MACCHINA -w1
![]()
![]() w4 __
-w 2
w4 __
-w 2
![]()
-q1
 serbatoio
termico
serbatoio
termico
T1
Si può dimostrare che il rendimento assume la forma:
![]() (11)
(11)
Combinando la (10) e la
(11), si ottiene l’espressione:
![]() (12)
(12)
Poiché è concettualmente
possibile ridurre un qualunque ciclo reversibile nella somma di un numero
grande quanto si vuole di cicli di Carnot operanti tra temperature vicine
quanto si vuole, la (12) assume la forma:
![]() (13)
(13)
dove dq rappresenta le
quantità di calore piccolissime scambiate in ogni ciclo infinitesimo.
Fermiamoci un attimo e
facciamo alcune considerazioni:
Affinché una macchina
termica possa produrre lavoro deve operare ciclicamente tra due temperature,
con espansioni e compressioni cicliche del fluido che lavora. Un altro modo,
infatti, di ottenere lavoro può essere quello di far espandere isotermicamente
un gas, prelevando calore da un’unica sorgente. Ma ciò non è realistico, poiché
comporterebbe l’uso di cilindri di espansione di lunghezza infinita e quindi di
nessuna utilità pratica. La macchina quindi deve ritornare ciclicamente al
punto di partenza, scaricando una certa aliquota del calore non utilizzato.
Pertanto non è possibile una
trasformazione isoterma del calore in lavoro senza una concomitante variazione
nel sistema o nell’ambiente.
Provate un po’ a pensare
cosa ciò comporterebbe: una nave potrebbe andare avanti senza alcun bisogno di
carburante, in quanto il lavoro necessario alla propulsione lo potrebbe
ottenere prelevando calore dal mare.
Tale estrazione continua di
lavoro dall’ambiente, che l’esperienza indica non essere possibile, prende il nome
di moto perpetuo di seconda specie.
La produzione di lavoro con un processo ciclico senza alcuna concomitante
variazione nell’ambiente (serbatoi termici nel caso del ciclo di Carnot), che è
anche impossibile, prende il nome di moto
perpetuo di prima specie.
A questo punto possiamo
formulare il Secondo Principio della
Termodinamica che può essere espresso in vari modi tra loro equivalenti:
Postulato di Kelvin: è impossibile l’esistenza di una macchina a funzionamento ciclico la quale produca come unico effetto
l’estrazione di calore da un serbatoio e la produzione di un’uguale quantità di
lavoro
(moto perpetuo di seconda specie).
Postulato di Clausius:
è impossibile l’esistenza di una
macchina a funzionamento ciclico la
quale produca come unico effetto il passaggio di calore da un corpo più freddo
ad uno più caldo.
La
formulazione di Kelvin del secondo principio della termodinamica mette in
evidenza l’asimmetria
della Natura. Infatti, mentre è impossibile convertire il calore totalmente in
lavoro, è possibile il contrario. Per esempio gli effetti dell’attrito possono
dissipare interamente il lavoro che viene prodotto, come quando una ruota viene
frenata. Tutta l’energia trasferita
all’ambiente esterno dal motore può venire dissipata in questo modo.
Qui
sta dunque la fondamentale asimmetria della Natura: benché il lavoro e il
calore siano equivalenti,
nel senso che entrambi rappresentano un modo per trasferire energia, essi non sono equivalenti per quanto riguarda la
possibilità di scambiarsi l’uno con l’altro. Bisogna tener presente però che
l’enunciato di Kelvin stabilisce l’impossibilità di convertire tutto il calore
in lavoro, nell’ipotesi che non si verifichino mutamenti
nell’ambiente circostante (universo), ma non nega che del calore possa
convertirsi completamente in lavoro quando siano contemporaneamente permessi
altri mutamenti. Un cannone, ad esempio, può sparare un proiettile: il calore
prodotto dalla esplosione della carica è intermante trasformato nel lavoro
rappresentato dal lancio del proiettile. Tuttavia questo è un processo
istantaneo e lo stato del sistema è completamente differente dopo l’esplosione
(ad esempio, il gas che ha spinto il proiettile non viene ricompresso). Ciò
vuol dire che si sono verificati mutamenti nell’ambiente esterno al cannone.
L’ENTROPIA
Il
Primo Principio, come abbiamo visto, tratta della costanza dell’energia di un
sistema non soggetto a influenze esterne; si riferisce cioè ad un sistema
isolato (vi ricordo che in termodinamica l’attenzione viene posta su una
regione chiamata sistema. Intorno ad esso vi è l’ambiente circostante.
I due, insieme, costituiscono l’universo. In pratica, l’universo può
essere solo una piccolissima frazione dell’Universo stesso, come l’interno di
un recipiente chiuso e termicamente isolato, oppure una certa quantità di acqua
mantenuta a temperatura costante).
Supponiamo
ora che esistano due stadi dell’universo; ad esempio in uno di essi un blocco
di metallo è caldo e l’ambiente circostante è freddo (Stato A), mentre
nell’altro è freddo ed in equilibrio termico con l’ambiente (che ora risulta
più caldo, avendo assorbito una parte di calore dal metallo) (Stato B) (figura
2).
fig. 2
Il Primo Principio afferma che il secondo stato può essere raggiunto a partire dal primo solo se l’energia totale dell’universo è la stessa per entrambi (la qual cosa è verificata, poiché l’universo è isolato). Il Secondo Principio prende in considerazione non l’aspetto che specifica l’energia dell’universo, bensì un altro che ne specifica l’entropia. Definiremo l’entropia in modo tale che se essa è maggiore nello stato B che nello stato A, allora lo stato B può essere raggiunto in modo spontaneo a partire dallo stato A. D’altra parte, anche nel caso in cui l’energia degli stati A e B è la stessa (come in questo caso), se l’entropia dello stato B è minore di quella dello stato A, allora lo stato B non può essere raggiunto in maniera spontanea senza rompere l’isolamento dell’universo, interferendo in qualche modo col nostro universo più grande (causando in questo un mutamento), per portare il sistema dallo stato A allo stato B. Definiamo quindi l’entropia in modo tale che in un universo qualunque essa aumenta quando avviene una trasformazione spontanea, e diminuisce nel caso di una trasformazione che non può verificarsi spontaneamente, ma che deve essere in qualche modo stimolata. Possiamo affermare quindi che: qualunque trasformazione spontanea è accompagnata da un aumento dell’entropia dell’universo. Questo enunciato viene chiamato principio dell’entropia ed è un’altra formulazione del Secondo Principio, equivalente ai postulati di Kelvin e di Clausius. Poichè quindi il principio dell’entropia è equivalente al postulato di Kelvin, l’entropia deve essere definita in modo più dettagliato, come una grandezza che aumenta quando al sistema viene fornito calore, ma rimane invariata quando viene compiuto un lavoro. Inoltre, per la necessaria equivalenza del principio dell’entropia anche col postulato di Clausius, la definizione dell’entropia deve includere la temperatura. In particolare la variazione di entropia che si verifica in un sistema è tanto più piccola quanto più alta è la temperatura alla quale avviene lo scambio di calore. In base a queste considerazioni possiamo matematicamente definire l’entropia nel modo seguente:
Variazione di entropia=(Calore
assorbito)/Temperatura
Dove il calore assorbito presenta il segno positivo se esso entra nel sistema, negativo se viene ceduto dal sistema all’ambiente. La Temperatura che compare nella formula è quella alla quale avviene il trasferimento del calore.
Esaminiamo ora nuovamente lo schema della macchina termica da un altro punto di vista:
Supponiamo di avere una certa quantità di energia che si possa
sottrarre ad una sorgente calda, e una macchina per trasformarla in lavoro.
Sappiamo che il secondo principio impone di avere anche una sorgente, a
temperatura inferiore. Facciamo quindi funzionare la macchina. Possiamo farle
produrre una certa quantità di lavoro e pagare la tassa che dobbiamo alla
Natura, scaricando una parte di energia sotto forma di calore nella sorgente a
bassa temperatura. Questa frazione di energia non è quindi più disponibile per
compiere un lavoro (a meno di non disporre di un’altra sorgente a temperatura
ancora più bassa). Quindi, in un certo senso, l’energia immagazzinata a
temperatura alta è di “qualità” migliore: l’energia di alta qualità è
utilizzabile per compiere un lavoro; l’energia di “bassa”qualità, l’energia
degradata, è utilizzabile in minor misura.
Un altro modo di considerare
la qualità dell’energia è di pensare in termini di entropia. Supponiamo di
assorbire una certa quantità di energia sotto forma di calore dalla sorgente a
temperatura più alta e facciamo in modo che questa volta venga direttamente
ceduta alla sorgente a temperatura inferiore. L’entropia dell’universo
diminuisce di una quantità pari a (calore assorbito)/Temperaturacalda, ma aumenta anche di una
quantità pari a (calore assorbito)/Temperaturafredda. La somma dei due
contributi produce una variazione globale di entropia positiva, poiché la
temperatura della prima sorgente è maggiore di quella della seconda. L’energia
dell’universo resta quindi meno utilizzabile per compiere lavoro (infatti
quando l’energia è immagazzinata a una temperatura inferiore si rende
necessaria la presenza di una sorgente a temperatura ancora più bassa se
vogliamo convertire questa energia in lavoro). Possiamo dunque dire che tale
energia è di qualità inferiore e che l’entropia ad essa associata è aumentata.
L’entropia, quindi, identifica il modo con cui l’energia si trova
immagazzinata. Pertanto possiamo affermare che la direzione spontanea di una
trasformazione, cioè quella che corrisponde ad un aumento di entropia, è quella
che produce una diminuzione della qualità dell’energia.
Quanto visto riguardo
all’energia e all’entropia è di grande importanza dal punto di vista pratico.
Il Primo Principio stabilisce che la quantità di energia di un universo è
costante. Perciò quando bruciamo combustibili fossili come carbone, petrolio e
nuclei atomici non diminuiamo la riserva di energia. Da questo punto di vista
non potrà mai esserci una crisi energetica, poiché la riserva globale di
energia rimarrà sempre la stessa. Tuttavia, tutte le volte che bruciamo un
blocco di carbone o una goccia di petrolio, e ogniqualvolta un nucleo si
disintegra, aumenta l’entropia del mondo (dato che tutti questi processi sono
spontanei). In altre parole, qualunque azione degrada la qualità dell’energia
dell’universo. Non siamo perciò nel mezzo di una crisi energetica: siamo sulla
soglia di una crisi di entropia, perché la civiltà moderna sta progressivamente
deteriorando le riserve di energia dell’universo. Ciò che dobbiamo fare non è
conservare l’energia, poiché la Natura lo fa automaticamente, ma amministrarne
con parsimonia la qualità. La conservazione della qualità dell’energia
rappresenta l’essenza del problema e il nostro compito per il futuro.
Ritorna all’inizio della pagina
“Con un po’ di pazienza, un po’ di comprensione, un
po’ di gioia e un po’ di umiltà, non avete idea di quanto potreste
trovarvi bene in questo nostro pianeta
Terra”
Gilbert
Chesterton, scrittore inglese