

Negli episodi
di inquinamento atmosferico si produce una notevole quantità di ozono
come conseguenza di reazioni fotochimiche a carico di inquinanti allo stato
gassoso. Tale fenomeno è detto smog fotochimico (il termine smog di per
sé è un acronimo che deriva dai termini inglesi “smoke”= fumo e “fog”=
nebbia).
Il processo attraverso cui si produce lo
smog è causato da una serie complessa di reazioni a cui partecipano molti
composti chimici. L’atmosfera delle città può quindi essere definita un
“reattore gigante”.
I principali
prodotti che innescano lo smog fotochimico sono:
a) il radicale monossido di azoto, NO·
b) le molecole incombuste di idrocarburi emesse nell’aria come
inquinanti dagli scarichi dei veicoli con motori a combustione interna
c) idrocarburi provenienti dall’evaporazione dei solventi
d) combustibili liquidi ed altri composti organici.
Nel complesso
le sostanze appartenenti alle categorie b),c),d) vengono definite composti
organici volatili, o COV.
I prodotti
finali dello smog sono ozono, acido nitrico e prodotti organici parzialmente
ossidati:
COV + NO·
+ luce solare → miscela di O3 +
HNO3 + prodotti organici
I reagenti di
questa equazione(COV e NO·
) sono chiamati inquinanti
primari, i prodotti sono chiamati inquinanti secondari.
Tra i COV, i composti più reattivi sono quelli contenenti doppi
legami CᆖC,
poiché possono produrre radicali liberi.
I gas
inquinanti contenenti ossidi d’azoto sono prodotti dalle combustioni di
combustibili fossili in presenza di aria. Alle elevate temperature raggiunte
nella combustione parte dell’azoto e dell’ossigeno presenti nell’aria si
combinano tra loro per formare NO· :
N2 + O2 → 2 NO·
Quanto più elevata è
la temperatura della fiamma, tanto maggiore è la quantità di NO· prodotta. Nel
giro di pochi minuti l’ossido di azoto viene ossidato dall’ossigeno a biossido
d’azoto NO2·. Nel loro insieme NO· e NO2· vengono
indicati come ossidi d’azoto NOx. Una piccola quantità di
tali ossidi si formano in natura anche a causa dei fulmini durante i temporali e
per l’azione della flora batterica nei terreni.
Perché in una città
si verifichi lo smog fotochimico, devono essere presenti numerose condizioni:
·
un intenso traffico di veicoli, a causa del
quale si producono e si accumulano quantità sufficienti di NO·, idrocarburi e
altri COV;
·
deve essere presente un clima caldo e
un’intensa radiazione solare perché possano procedere velocemente le reazioni
cruciali per la formazione dello smog;
·
la massa d’aria deve rimanere relativamente
ferma affinché i reagenti non siano diluiti.
Per
migliorare la qualità dell’aria è necessario quindi ridurre la produzione di
ozono. Perché ciò accada, a sua volta è importante abbassare il livello degli
ossidi d’azoto, NOx e di C.O.V. e, tra questi, degli idrocarburi
contenenti legami CᆖC.
Si
è osservato, in particolare, che la
riduzione dell’ozono nell’atmosfera delle città dipende strettamente dalla
riduzione degli ossidi d’azoto. Infatti una riduzione iniziale di idrocarburi
nell’aria non riduce sensibilmente l’ozono, almeno fino a quando questi sono in
grande eccesso.
Vi
è da sottolineare comunque che le aree urbane che confinano con zone molto
boscose o che contengono al loro interno ampie zone verdi con elevata
concentrazione arborea presentano quantità rilevanti di idrocarburi reattivi,
tali da sostenere la produzione di smog anche quando è bassa la concentrazione
di idrocarburi prodotti dalle attività umane. Responsabili della produzione di
tali idrocarburi sono gli alberi decidui e gli arbusti che emettono soprattutto
il gas isoprene,
e le conifere, che emettono pinene
e limonene. Le molecole
dei tre idrocarburi suddetti contengono infatti legami CᆖC. Quindi nelle
aree caratterizzate dalla presenza di vegetazione, solo la riduzione
dell’emissione degli ossidi d’azoto può ridurre sostanzialmente la produzione
di smog fotochimico.
Allo
scopo di minimizzare le emissioni degli ossidi d’azoto, da alcuni anni sugli
autoveicoli alimentati a benzina sono montati i convertitori catalitici, posti
a valle della marmitta. Gli originali convertitori a due vie, in grado
di agire sulle molecole gassose contenenti carbonio, compreso il monossido ci
carbonio,CO, sono stati progressivamente sostituiti dai convertitori a tre
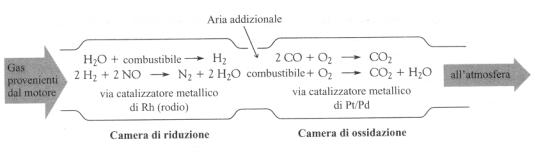
vie, nei quali viene utilizzato un catalizzatore a base di rodio. Esso
funziona schematicamente in questo modo: 1) in una prima camera, detta camera
di riduzione, gli ossidi d’azoto vengono trasformati in azoto elementare,
utilizzando idrocarburi incombusti, CO e H2 come agenti riducenti e
il rodio come catalizzatore; 2) in una seconda camera, detta camera di
ossidazione, grazie all’immissione di aria e alla presenza di un catalizzatore
a base di platino, i gas contenenti carbonio vengono ossidati quasi
completamente ad anidride carbonica, CO2, ed acqua. Nella figura
sottostante è illustrato il funzionamento di una marmitta catalitica:
Impianti
a combustione di grosse dimensioni, come ad esempio le centrali
termoelettriche, sono stati modificati con l’introduzione su grande scala dei
convertitori catalitici, sempre allo scopo di ottenere la trasformazione degli
ossidi d’azoto in N2, prima della loro liberazione in atmosfera. Il
funzionamento di tali sistemi catalitici prevede l’aggiunta di ammoniaca, NH3,
al flusso di gas. Infatti, in presenza di ossigeno, essa si combina con NO·,
producendo azoto elementare, secondo la reazione:
4NH3 +
4NO· + O2 → 4N2 + 6H2O
L’aggiunta di ammoniaca deve essere effettuata sotto
stretto controllo per impedirne la non desiderata ossidazione a NOx·.
In una tecnologia simile, l’urea, CO(NH2)2,
viene iniettata, con modalità opportune, direttamente nella fiamma di combustione,
dove reagisce subito con l’NO· per produrre N2, in presenza di un catalizzatore:
2CO(NH2)2 + 4NO· + O2 → 4N2 +
2CO2 + 4H2O
Anche nelle zone rurali tropicali, durante la stagione
secca, può verificarsi la produzione di ozono in seguito all’uso di bruciare la
biomassa derivante dalla deforestazione di ampie superfici. Infatti, sebbene la
maggiorparte del carbonio sia immediatamente trasformato in CO2,
vengono altresì prodotte una certa quantità di metano ed altri idrocarburi, nonché
di NOx·. Quando questi idrocarburi, per effetto della
luce solare, reagiscono con gli ossidi d’azoto, viene prodotto ozono.
LE
REAZIONI FONDAMENTALI NELLO SMOG FOTOCHIMICO
Sebbene
la complessità del processo di formazione dello smog sia molto grande, le sue
caratteristiche più importanti possono essere comprese considerando alcuni tipi
principali di reazioni, fra esse correlate.
Innanzitutto
nell’aria della troposfera si trova sempre una certa quantità di radicali
ossidrile, prodotti per reazione del vapore acqueo con gli atomi di ossigeno
provenienti dalla decomposizione fotochimica della piccola quantità di ozono
presente nella troposfera stessa:
O3 → O2 + O*
O* + H2O → 2OH·
E’
proprio il radicale ossidrile il responsabile della fase iniziale delle
reazioni di ossidazione di molti gas inquinanti, e del loro successivo
allontanamento. Da ciò la grande importanza che riveste questo radicale,
definito appunto “aspirapolvere dell’atmosfera”. Anche l’ossidazione
atmosferica del metano a CO2 ha come effetto collaterale la
produzione di radicali ossidrile.
Come abbiamo già detto, un ruolo
primario nella formazione dello smog è giocato dai COV, in particolare da
idrocarburi contenenti doppi legami nella loro molecola. La loro ossidazione
comincia proprio con la reazione del radicale ossidrile. Consideriamo perciò un
idrocarburo generico di formula
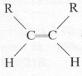
Il
radicale ossidrile attacca il doppio legame, rompendo il legame π e
producendo un radicale carbonioso:
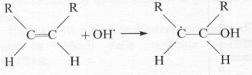
che
attacca a sua volta l’ossigeno atmosferico, formando un radicale perossido
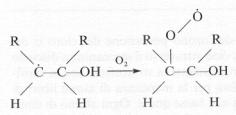
Quest’ultimo cede un
atomo di ossigeno al radicale monossido NO·, producendo il radicale biossido
d’azoto:
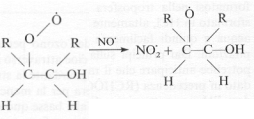
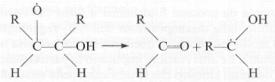
Il radicale organico si
decompone spontaneamente per rottura del legame C˿C, con formazione di
un’aldeide e un altro radicale carbonioso:
Il radicale carbonioso reagisce con l’ossigeno
atmosferico formando un’altra molecola di aldeide e il radicale idroperossido:
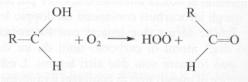
In tal modo la
molecola inquinante originaria è stata trasformata in due molecole di aldeide,
le quali sono decomposte fotochimicamente in modo rapido in due radicali:
RCHO → R· + HCO·
Si può notare che in
una delle reazioni intermedie di questa sequenza che porta all’ossidazione dei
COV, il radicale monossido, NO·, si trasforma in radicale biossido, NO2·,
che perciò si accumula nella troposfera in maniera tanto più significativa
quanto più alto è il contenuto di COV. Il radicale biossido a sua volta, ad
opera della componente UV-A della luce
solare, si decompone in NO· e O·. Il radicale ossigeno attacca poi rapidamente
una molecola di ossigeno O2, producendo così ozono, O3:
NO2· → NO·
+ O·
O· + O2 → O3
Questa è la reazione fondamentale
che causa la formazione dell’“ozono urbano”.
La decomposizione
dell’ozono e delle aldeidi che si formano nello stadio finale della sequenza
delle reazioni ossidative dei COV, indotta dalla luce solare, causa perciò un
notevole aumento del numero di radicali liberi presenti nell’aria di una città
sottoposta a smog fotochimico.
Nei periodi di
maggiore inquinamento diventano quindi importanti le reazioni nelle quali si
producono molecole non radicaliche per somma di due radicali, essendo in tali momenti
elevata la loro concentrazione nell’aria:
radicale +
radicale → molecola non radicalica
Tra queste, quelle
che rivestono maggiore importanza per le sostanze che producono sono:
a) la
combinazione tra radicale ossidrile e
radicale biossido di azoto, con formazione di acido nitrico:
OH· + NO2· → HNO3
La
vita media dell’acido nitrico nell’atmosfera è di alcuni giorni. Esso infatti è
facilmente solubile nelle gocce di pioggia e quindi ricade a terra, oppure si
decompone fotochimicamente.
b) La
combinazione tra radicali ossidrili e radicali monossido di azoto, con
formazione di acido nitroso:
OH· + NO·
→ HNO2
La
luce solare decompone nuovamente l’acido nitroso mediante la reazione inversa.
c) La
combinazione tra due radicali ossidrile o tra due radicali idroperossido, con
formazione, in entrambi i casi, di perossido di idrogeno (acqua ossigenata):
2OH· → H2O2
2OOH· → H2O2 + O2
I PARTICOLATI NELL’INQUINAMENTO DELL’ARIA
I
particolati sono le minuscole particelle
solide o liquide sospese nell’aria. Un aerosol è un insieme di
particelle solide e goccioline liquide disperse nell’aria, le cui dimensioni
sono solitamente inferiori a 100 μm. Solitamente vengono utilizzati i nomi
di “polvere” o “fuliggine” per indicare le dispersioni di particelle solide e
“caligine” e “nebbia” per indicare rispettivamente particelle liquide in
generale e goccioline di acqua.
Una
delle più importanti fonti del particolato a base di carbonio presente
nell’atmosfera è rappresentata dalle emissioni dei motori diesel.
La
velocità di sedimentazione dei particolati aumenta col quadrato del loro
diametro. Perciò particelle molto piccole cadono così lentamente che possono
rimanere per tempi lunghissimi in sospensione nell’atmosfera. Le particelle con
diametro inferiore a 2,5μm sono dette genericamente particolato fine
e solitamente rimangono nell’aria per giorni o settimane. Le particelle con
diametro maggiore di 2,5μm sono dette particolato grossolano e sedimentano
piuttosto rapidamente.
Oltre
che per sedimentazione, le particelle possono essere allontanate dall’aria per
absorbimento nelle goccioline di pioggia.
La
concentrazione dei particolati nell’aria viene espressa come massa di
particelle per volume d’aria, di solito μg/m3, ed è indicata
col nome di particolato totale in sospensione, abbreviata come PTS.
Uno standard comunemente accettato per il PTS è il valore di 75 μg/m3.
Poiché,
però, solo le particelle più piccole sono respirabili e quindi rivestono
maggiore importanza per la salute umana, viene più spesso utilizzato come
indice la concentrazione delle particelle aventi un diametro inferiore a 10μm.
Essa viene indicata col nome di Materia Particolata (Particulate
Matter), PM10.
Infine
le particelle con diametri compresi nella banda delle lunghezze d’onda della
luce visibile, cioè tra 0,4 e 0,8μm, possono interferire con la
trasmissione della luce nell’aria, riducendone la chiarezza e diminuendo la
visibilità a lunga distanza e la quantità di luce che raggiunge il suolo.
La
diffusa foschia che si registra in inverno nell’atmosfera dell’artico è dovuta
agli aerosol di acido solforico originati dalla combustione del carbone,
soprattutto in Russia e in Europa, mentre l’aumento della nebbiosità che si riscontra
sopra gran parte del Nordamerica è dovuta in larga misura agli aerosol di acido
solforico provenienti dalle aree industrializzate degli Stati Uniti e del
Canada.