![]() Home page
Home page
![]() torna
al menu quarte classi
torna
al menu quarte classi
INDICE DEGLI ARGOMENTI
Ø
IDROLISI DI SALI CON ANIONE DERIVANTE DA ACIDO POLIPROTICO
DEBOLE CON BASE FORTE (esempio del carbonato di sodio)
Ø CALCOLO DEL pH DI
SOLUZIONI DI SALI DERIVANTI DA UN ACIDO E DA UNA BASE ENTRAMBI DEBOLI
Ø IRDOLISI DI SALI
ACIDI DERIVANTI DA ACIDI POLIPROTICI DEBOLI CON BASE FORTE
(esempio del bicarbonato di sodio)
![]()
IDROLISI DI SALI CON ANIONE DERIVANTE DA ACIDO
POLIPROTICO DEBOLE CON BASE FORTE
Consideriamo, a titolo di esempio,
il carbonato di sodio, Na2CO3. Come tutti i sali, esso è
un elettrolito forte e, sciolto in acqua, si dissocia totalmente:
(*) Lo ione H+
non esiste isolato, ma associato ad una molecola di acqua, formando così lo
ione ossonio H3O+.Tuttavia,
per maggiore facilità di scrittura,
in questa pagina verrà indicato come ione H+.![]()
Na2CO3 2Na+ + CO32-
L’anione CO32- proviene dall’acido debole H2CO3,
biprotico debole, dal quale derivano due
equilibri di dissociazione acida:
![]()
![]() 1) H2CO3 H CO3- +
H+ (*)
1) H2CO3 H CO3- +
H+ (*)
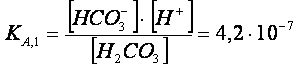
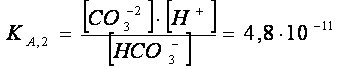
Perciò esso presenta due equilibri successivi d’idrolisi
con effetto basico, a cui corrispondono le due seguenti costanti di idrolisi:
![]()
![]() IDROLISI PRIMARIA CO32- + H2O H CO3- + OH-
IDROLISI PRIMARIA CO32- + H2O H CO3- + OH-
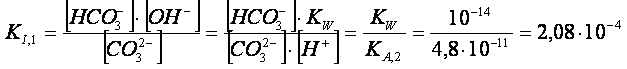
![]()
![]() IDROLISI SECONDARIA H CO3- +
H2O
H2CO3
+ OH-
IDROLISI SECONDARIA H CO3- +
H2O
H2CO3
+ OH-
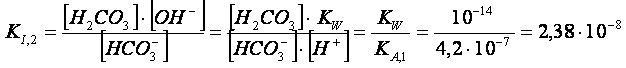
Come si può ben vedere, la costante di idrolisi secondaria è
10.000 volte più piccola della costante di idrolisi primaria, pertanto il secondo equilibrio
di idrolisi dà un contributo di ioni ossidrili trascurabile rispetto al primo.
Esso, perciò, si può ignorare.
Il pOH della soluzione, e quindi il pH, può
essere perciò calcolato con la stessa formula trovata per i sali provenienti da
acidi monoprotici deboli, inserendo la costante primaria
di idrolisi:
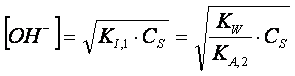
dove Cs è la concentrazione del
carbonato di sodio
Dalla
relazione:
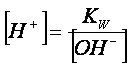
conoscendo
la concentrazione degli ioni ossidrile, si calcola quella degli ioni idrogeno,
e quindi il pH della soluzione.
Quanto
detto per il carbonato di sodio, sale neutro derivante dall’acido carbonico,
biprotico debole, vale anche per i sali neutri derivanti da acidi triprotici
deboli, come l’acido fosforico, arsenico, ecc., e dagli acidi poliprotici in
generale.
CALCOLO DEL pH DI SOLUZIONI DI SALI
DERIVANTI DA UN ACIDO E DA UNA BASE ENTRAMBI DEBOLI
Consideriamo un sale generico di
formula M+B-, dove M+ è il catione derivante dalla base debole MOH e B- è
l’anione derivante dall’acido debole HB. Essendo un elettrolito forte, il
sale, che si suppone solubile in acqua, si dissocia completamente negli ioni
che lo costituiscono:
![]() M+B-
M+ + B-
M+B-
M+ + B-
Poiché gli ioni positivo e negativo sono rispettivamente l’acido e la base
coniugati relativamente forti di una base (MOH) e di un acido (HB) deboli, entrambi reagiranno con
l’acqua, essendo essa un solvente anfiprotico, dando luogo alle seguenti
reazioni di idrolisi:
![]()
![]() (1) M+ + H2O MOH + H+
(1) M+ + H2O MOH + H+
regolato da una costante parziale di idrolisi,
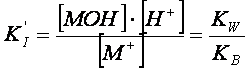
e
![]()
![]() (2) B- + H2O HB + OH-
(2) B- + H2O HB + OH-
regolato
da una costante parziale di idrolisi,

In base ai valori di tali costanti, le concentrazioni degli ioni H+ e OH- che si
originano dalle due reazioni hanno, di solito, valori differenti. Esse
influenzano la posizione dell’equilibrio della
reazione di autoprotolisi dell’acqua,
![]()
![]() H2O H+ + OH-
H2O H+ + OH-
che è simultaneo agli altri
due equilibri di idrolisi, e comunque saranno tali da soddisfare il prodotto ionico
dell’acqua, Kw:
![]()
L’equilibrio totale di idrolisi può essere
così indicato:
![]()
![]() M+B- + H2O MOH + HB
M+B- + H2O MOH + HB
a cui compete la costante totale di
idrolisi:
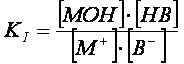 (1)
(1)
La costante totale di idrolisi KI è correlata
alle altre costanti K’I, K’’I e Kw.
Infatti:
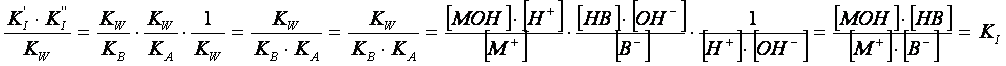
In definitiva:
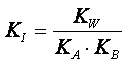 (2)
(2)
Per il calcolo del pH, osserviamo che una
formula approssimata può essere ottenuta effettuando il rapporto tra le
costanti parziali di idrolisi. Infatti:
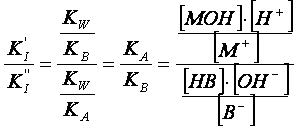 (3)
(3)
Poiché,
nella gran parte dei casi i valori delle costanti parziali di idrolisi sono
piccoli, e quindi i relativi equilibri spostati a sinistra, possiamo
considerare, con buona approssimazione, valide le seguenti eguaglianze:
![]() e
e ![]()
Perciò la (3) si semplifica nella seguente
espresione:
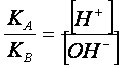 (4)
(4)
Ma dal prodotto ionico dell’acqua possiamo
scrivere:
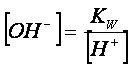
Perciò la (4) diventa:
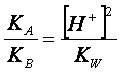
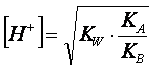 (5)
(5)
E’ interessante notare che in tale formula
approssimata non compare la concentrazione del sale. In base ad essa si deduce
che:
Ø
Se Ka=Kb
si ha: [H+]=10-7 quindi
pH=7
Ø
Se Ka>Kb
si ha: [H+]>10-7 quindi
pH<7
Ø
Se Ka<Kb
si ha: [H+]<10-7 quindi
pH>7
La formula esatta per il calcolo del pH,
di cui non daremo la dimostrazione, è, invece, la seguente:
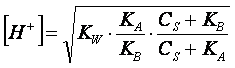
nella quale compare la concentrazione del
sale, CS. Come
si può notare dalla formula, se i valori di Ka e di Kb
sono molto più piccoli di CS, e quindi trascurabili rispetto alla
concentrazione del sale, essa si riduce alla formula approssimata (5).
Per i nostri scopi, poiché considereremo sempre concentrazioni saline
sufficientemente elevate, sarà sufficiente applicare l’equazione (5).
IRDOLISI DI SALI
ACIDI DERIVANTI DA ACIDI POLIPROTICI DEBOLI CON BASE FORTE
In questi casi bisogna tener presente che
nel sistema sono presenti simultaneamente equilibri di idrolisi a effetto
basico e equilibri di dissociazione acida.
Consideriamo, come esempio, una soluzione
di bicarbonato di sodio (o carbonato acido di sodio), NaHCO3. Come
tutti i sali, elettroliti forti, esso si dissocia completamente nei suoi ioni
costituenti:
![]() NaHCO3 Na+ +
HCO3-
NaHCO3 Na+ +
HCO3-
Mentre lo ione sodio, che deriva da una
base forte, non reagisce con l’acqua, l’anione bicarbonato partecipa a due
equilibri simultanei:
1. ![]()
![]() HCO3- +
H2O H2CO3 + OH- idrolisi
HCO3- +
H2O H2CO3 + OH- idrolisi
![]()
![]() 2.
HCO3- + H2O CO3-2 +
H3O+ dissociazione acida
2.
HCO3- + H2O CO3-2 +
H3O+ dissociazione acida
Il primo è regolato dalla costante di
idrolisi:
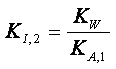 (*) (vedi il primo argomento di
questa pagina)
(*) (vedi il primo argomento di
questa pagina)
Il secondo è regolato dalla costante acida
di seconda dissociazione dell’acido carbonico KA,2:
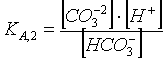
(*) (vedi il
primo argomento di questa pagina)
In
pratica, in modo del tutto casuale, tra gli ioni bicarbonato presenti nella
soluzione alcuni reagiscono comportandosi da base di Bronsted, dando luogo al
fenomeno di idrolisi (primo equilibrio), altri si dissociano trasferendo il
protone residuo all’acqua, comportandosi come acido di Bronsted (secondo
equilibrio).
A ben
vedere, lo ione bicarbonato, che
subisce sia una dissociazione acida che una dissociazione basica, si
comporta come un sale proveniente da un acido e una base entrambi deboli (vedi il secondo argomento di questa pagina).
L’unica differenza consiste nel fatto che in quest’ultimo
la natura degli ioni che partecipano alle reazioni acido-base con l’acqua è
diversa, mentre nel caso dello ione bicarbonato, gli ioni sono gli stessi. Perciò per il calcolo del pH possiamo utilizzare la formula
approssimata ricavata per le soluzioni di elettroliti derivanti da acido e base
entrambi deboli(vedi il secondo argomento di questa pagina):

dove, nel caso specifico, al posto di KA dobbiamo inserire

Che diventa:
![]()
Da cui si calcola il pH.
Quanto detto per il bicarbonato di sodio,
che deriva dall’acido carbonico, biprotico debole, vale per i sali acidi
derivanti da acidi triprotici deboli, come l’acido fosforico, arsenico, ecc., e
dagli acidi poliprotici in generale.