INDICE DEGLI ARGOMENTI
1. ESERCIZI SULL’ELETTROLISI DI SOLUZIONI ACQUOSE
2. DATI DI CONDUCIBILITA’ ELETTRICA DELLE SOLUZIONI
3. PROBLEMI DI ELETTROCHIMICA
4. ESERCIZI DI CHIMICA ORGANICA
ESERCIZI SULL’ELETTROLISI DI SOLUZIONI ACQUOSE
1. Una soluzione salina, sottoposta ad elettrolisi,
fornisce i seguenti dati:
![]() aumento della massa al catodo: 0,675 g;
aumento della massa al catodo: 0,675 g;
![]() intensità della corrente elettrica: 0,75 A;
intensità della corrente elettrica: 0,75 A;
![]() durata dell’elettrolisi 45,0 minuti;
durata dell’elettrolisi 45,0 minuti;
Calcolare il peso equivalente del metallo che
costituisce il catione.
(risoluzione:
P.E.=32,2)
2. Una corrente elettrica deposita 200 g di zinco in 8
ore. Per quanto tempo essa deve passare attraverso una soluzione di NaCl perché
si sviluppi 1 m3 di cloro in condizioni normali, assumendo che
l’ossidazione di Cl- sia l’unica reazione che ha luogo all’anodo?
(risoluzione:
116,7 ore)
(ricordate che in condizioni normali, cioè alla pressione di 1 atm e alla temperatura di 273 °K, una mole di qualunque gas occupa il volume di 22,4 litri)
3. Una corrente di 12 Ampère passa attraverso una soluzione di CrCl3 per 40 minuti. Quanti grammi di cromo vengono elettrodeposti e quanti m3 di cloro gassoso misurato a condizioni normali si sviluppano?
(risoluzione: Cr: 5,2 g; Cl: 3,3·10-3
m3)
(esercizi
aggiunti il 07/12/02)
4. La stessa quantità di elettricità che deposita 2,16
g di argento, passando attraverso una soluzione di sale di oro, deposita 1,31 g
di oro metallico. Sapendo che i peso equivalente dell’argento è 107,9,
calcolare: a) il peso equivalente dell’oro, b) lo stato di ossidazione dell’
oro nel sale.
(risoluzione: a) 65,7; b) 3)
5. Durante l’elettrolisi di una soluzione acquosa di
CuSO4 il catodo subisce in 10 minuti un aumento di peso di 0,287 g.
Calcolare l’intensità di corrente.
(esercizi aggiunti il 07/12/02)
6. Calcolare il numero di cationi ridotti alla
superficie di un catodo durante ciascun secondo in cui una cella elettrochimica
lavora con 0,02 Ampère e gli ioni coinvolti sono: a) monovalenti; b) bivalenti;
c) trivalenti.
(risoluzione: a) 12,4·1016
cationi; b) 6,2·1016 cationi; c) 4,14·1016 cationi)
7. Calcolare il tempo necessario per depositare, ad
una corrente costante di 1,2 Ampère, 0,5 g di a) Tl+3 (tallio+3)
come tallio metallico, al catodo; b) Tl+1 come Tl2O3,
all’anodo; c) Tl+1 come tallio metallico, al catodo.
8. Calcolare il tempo necessario per depositare, ad
una corrente costante di 0,961 A, 0,5 g di cobalto (Co+2) : a) come
cobalto elementare sulla superficie di un catodo; b) Co3O4
su di un anodo.
(risoluzione: a) 28,4 minuti; b) 9,47
minuti)
9. Viene condotta una elettrolisi di una soluzione di
solfato rameico. Se il diagramma temporale della corrente è il seguente,
determinare i grammi di rame metallico depositato al catodo.
![]()
I
![]()

![]() 1,7
A
1,7
A
![]()
4,5 ore 6,6 ore t
10.
Due celle
elettrolitiche vengono poste in parallelo e sottoposte ad una d.d.p. di 5 volt.
Nella prima vi è una soluzione di solfato di zinco e ha una resistenza di 150
ohm, la seconda contiene una soluzione di solfato rameico e presenta una
resistenza di 250 ohm. Si effettua l’elettrolisi delle due soluzioni per un
tempo di 75 minuti. Supponendo che la resistenza delle due soluzioni rimanga
invariata durante l’elettrolisi, determinare:
a)
il rapporto fra gli equivalenti
di zinco e di rame che si depositano ai rispettivi catodi;
b)
il rapporto fra le
masse di zinco e di rame che si depositano ai rispettivi catodi;
c)
Se agli anodi di
entrambe le celle si sviluppa ossigeno (per ogni molecola di ossigeno, O2,
che si forma all’anodo vengono ceduti 4 elettroni), supponendo di raccoglierlo e di immetterlo in un volume di 20
litri, alla temperatura di 17 °C, quale sarà il valore della pressione ?
aggiunto il 28/12/03
11.
In una soluzione
acquosa sono presenti i seguenti elettroliti, tutti in concentrazione 1M: CuI2, ZnI2, CoI2.
Si suppone che il pH della soluzione rimanga al valore 7. Le reazioni che
possono verificarsi al catodo e all’anodo sono le seguenti:
|
reazioni al catodo |
Potenziali
standard redox |
Reazioni all’anodo |
Potenziali
standard redox |
|
Zn++ +
2e-→ Zn |
E°=-0,76
Volt |
2I-
→ I2 +
2e- |
E°=+0,534Volt |
|
Cu++ +
2e-→ Cu |
E°=+0,34
Volt |
H2O→½ O2 +2H+ + 2e- |
E°=+1,23
Volt |
|
Co++ +
2e-→ Co |
E°=-0,277Volt |
|
|
|
2H2O
+ 2e-→ H2 +
2OH- |
E°=-0,828Volt |
|
|
Supponendo di applicare agli elettrodi della cella una differenza di potenziale crescente a partire da zero, qual è il valore teorico minimo della d.d.p. da applicare affinché incominci l’elettrolisi? Quali saranno le coppie redox che reagiranno per prime, depositandosi rispettivamente al catodo e all’anodo?
aggiunto il 28/12/03
12.
De celle
elettrolitiche, poste in serie, vengono attraversate da una corrente costante
di 2 Ampère. Dopo un certo tempo di elettrolisi, nella prima, contenente AgNO3
(nitrato di argento) si sono depositati 25 g di argento metallico al catodo.
Nella seconda, la quantità di metallo depositata al catodo è di 6,79 g. Sapendo
che il peso equivalente dell’argento è 107,8 determinare: a) il tempo di
elettrolisi; b) il peso equivalente del metallo; c) il numero di elettroni che
esso acquista nel processo di riduzione al catodo, sapendo che il suo peso
atomico è 59.
13.
Ad una cella
elettrolitica contenente nitrato di argento, AgNO3, viene applicata
una corrente costante di 2,5 Ampère per 5 ore. Dopo tale tempo essa assume
repentinamente il valore di 1,7 Ampère, che viene mantenuto costante per 20
minuti. Dopo tale intervallo di tempo essa decade linearmente nel tempo, fino a
raggiungere, dopo 3 ore, il valore di 0,5 Ampère che rimarrà costante per le 2
ore successive. Calcolare i grammi di argento (P.A.=107,8) depositati al catodo
alla fine dell’elettrolisi. Disegnare il diagramma corrente/tempo.
aggiunto il
28/12/03
![]()
![]()
![]()
![]()
![]()
![]()
![]()
risoluzione
dell’esercizio n°6
dalla formula ![]() ricaviamo che in
un secondo, la carica che fluisce agli elettrodi è:
ricaviamo che in
un secondo, la carica che fluisce agli elettrodi è:![]() Impostiamo la seguente proporzione:
Impostiamo la seguente proporzione:
1eq:96500
C = x:0,02 C
da cui x=2,07·10-7 equivalenti che si depositano
in un secondo. Sappiamo anche che ne=n·z, da cui n= ne
/z. Se lo ione che si deposita al catodo è monovalente, z=1 perciò ne=n.
Quindi n=2,07·10-7moli. Sapendo che una mole
contiene 6·1023 molecole o ioni, impostiamo la proporzione
seguente:
1 mole :
6·1023 = 2,07·10-7moli : x
da cui x= 12,4·1016 ioni
monovalenti che si depositano in un secondo.
Per gli ioni bivalenti n= ne
/z=2,07·10-7/2=
1,03·10-7.
Quindi gli ioni sono 1 mole : 6·1023
= 1,03·10-7moli : x
da cui x= 6,2·1016 ioni
bivalenti che si depositano in un secondo.
Per gli ioni trivalenti n= ne
/z=2,07·10-7/3=
0,69·10-7.
Quindi gli ioni sono 1 mole : 6·1023 =
0,69·10-7moli : x
da cui x= 4,14·1016 ioni
trivalenti che si depositano in un secondo.
![]()
DATI
DI CONDUCIBILITA’ ELETTRICA DELLE SOLUZIONI
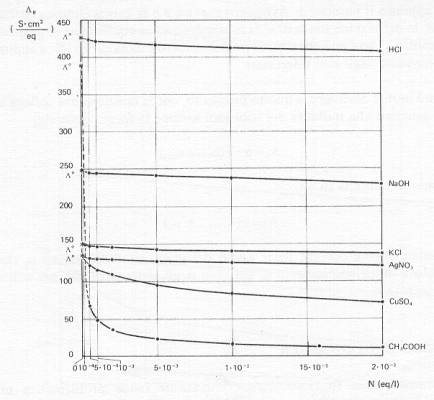
Tab. 1- Conducibilità
equivalenti limite l° di alcuni cationi ed anioni (S × cm2
× eq-1 ) a 25°
|
CATIONI |
ANIONI |
||
|
H+ |
350 |
OH- |
198,6 |
|
K+ |
73,5 |
SO42- |
80 |
|
NH4+ |
73,5 |
Cl- |
76,4 |
|
Ag+ |
61,9 |
NO3- |
71,4 |
|
Na+ |
50,1 |
CO32- |
69,3 |
|
Ba2+ |
63,6 |
HCO3- |
44,5 |
|
Pb2+ |
69,5 |
CH3 COO- |
40,9 |
Variazione della conducibilità equivalente di alcuni elettroliti con la concentrazione:
PROBLEMI DI
ELETTROCHIMICA
1. Per determinare la concentrazione di Cu++ in una soluzione viene posto in essa un elettrodo di rame (EoCu++/Cu=+0,346 V), collegando il tutto, mediante un ponte salino, ad un elettrodo a calomelano (E=+0,242 V). La f.e.m. della pila risultante è di 0,024V. Calcolare [Cu++].
[risposta: 2·10-3 mol/l]
2. Stabilire con quale rapporto [Cu+]/[Fe+3], la f.e.m. della seguente pila ,
Pt│Fe+3 (0, 1M), Fe+2 (0,1 M) ││Cu+ │Cu
Si annulla. (osservare che la molarità di Cu+ non è specificata, poiché si deve determinare) (EoCu+/Cu= + 0,52 V; EoFe+2/Fe+3 = + 0,77 V)
3. stabilire il verso del flusso di elettroni e la f.e.m. di una pila a concentrazione così schematizzabile:
Pt│Mn++ (0,1M), MnO4- (10-4M), pH = 3,5││ Mn++ (10-5M), MnO4- (1M), pH = 0│Pt
[risposta: f.e.m.=0,43 V]
4. Una pila è così costituita:
Ag│AgNO3 (0,1 M) ││KIO3 (0,2 M), KI (0,3M), pH = 2│Pt
1)Stabilire se è scritta correttamente, o se bisogna invertire gli elettrodi, dopo aver determinato il loro potenziale attuale, sapendo che EoAg+/Ag=+0,799 V e che EoIO3-/I-=+1,08 V
2) la f.e.m.della pila.
3) se essa viene collegata in serie ad una resistenza di 30 ohm ed ad una batteria che eroga una tensione di 1 volt in modo che le polarità di questa si contrappongano a quelle della pila, determinare: a) la corrente che passa nella resistenza;
b) se è possibile, variando il la concentrazione idrogenionica (pH) nella
semicella di destra della pila, ottenere una f.e.m. tale da contrastare,
eguagliandola, la d.d.p.della batteria. In questo caso calcolare il pH
necessario a tale scopo e indicare il nuovo valore della corrente nella
resistenza.
5. Un elettrodo di platino è immerso in una soluzione di cloruro ferroso e cloruro ferrico rispettivamente 0,2 M e 0,08 M. Tale elettrodo viene accoppiato ad un elettrodo di platino immerso in una soluzione contenente permanganato di potassio KMnO4 e cloruro di Manganese MnCl2, rispettivamente 0,2 M e 0,5 M a pH = 4. 1) Determinare la f.e.m. della pila; 2) Indicare la specie degli elettrodi; 3) Indicare se è possibile, cambiando opportunamente le concentrazioni dei costituenti, annullare la f.e.m. della pila. (E°Fe+++/Fe++=+0,77 volt; E°MnO4-/Mn++=+1,49 volt)
6. Una cella galvanica è composta da due semicelle costituite da due elettrodi di nichel ricoperti di un sottile strato di NiO2, biossido di nichel, immersi rispettivamente in una soluzione a pH 9 e in una soluzione a pH 13. Sapendo che la reazione elettrodica è la seguente:
NiO2 + 2H2O + 2e- → Ni(OH)2
+ 2OH-
1) determinare la f.e.m. della cella galvanica;
2) scrivere simbolicamente in modo corretto la cella galvanica, indicando quindi il polo negativo e quello positivo;
3)dire a quale valore del pH la f.e.m. della pila si annulla;
4) indicare il tipo di cella galvanica
ESERCIZI DICHIMICA ORGANICA
A) ESERCIZI SULLE SINTESI ORGANICHE
7. Partendo da un alchene e avendo a disposizione qualunque altro reattivo, effettuare la sintesi del seguente composto:

8. Partendo dal 2 butene e avendo a disposizione qualunque altro reattivo, effettuare la sintesi del seguente composto:

9. Partendo dal benzene e da qualunque altro reattivo, effettuare la sintesi del seguente composto:

10. Partendo dall’1-3 dicloro propano effettuare la sintesi del seguente composto:

11. Partendo dal 2 pentino, sintetizzare il seguente composto:

12. Partendo dal benzene, sintetizzare il seguente composto:

13. Partendo dal benzene, sintetizzare il seguente composto:

14. Partendo dal propanone (acetone) e utilizzando solo composti carbonilici, sintetizzare il seguente composto:

15. Partendo dal benzene, ed utilizzando solo cloruri alchilici, fare la sintesi del seguente composto:

16. partendo da benzene, effettuare la sintesi del seguente composto:

17. Partendo dall’1-butene e utilizzando qualunque altro reagente, effettuare la sintesi del seguente composto, assegnandogli il corretto nome I.U.P.A.C.:
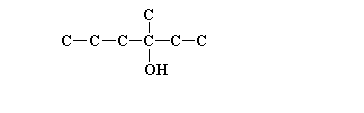
18. Partendo dall’1-butanolo e utilizzando un qualunque altro reagente, effettuare la sintesi del composto dell’esercizio n°11.
19. Partendo dal benzene effettuare la sintesi del seguente composto:

B) DOMANDE TIPO PER TEST SULLA TEORIA
20. Da quale reattivo di Grignard partiresti per ottenere l’acido esanoico? Scrivere l’equazione di sintesi, indicando il nome e le formule dei reagenti e dei composti.
21. Qual è la formula generale delle cianidrine? Attraverso quale reazione si possono sintetizzare? Descrivere il meccanismo di tale reazione.
22. Completare la seguente equazione, indicando le formule di struttura, e il nome ove manca, di tutti i composti organici:
---------------------------------------- + acido 5 cloro, 5 metil eptanoico → N metil, 5 cloro, 5 metil eptanammide
23. Cosa sono gli esteri? Illustrare in dettaglio il meccanismo della reazione di sintesi di tali composti.
24. Scrivere l’equazione relativa alla reazione di una generica ammina alifatica primaria con acido nitroso.