![]() Home page
Home page
![]() torna al menu terze classi
torna al menu terze classi
I FENOMENI DI ELETTROLISI
Lo studio dell’azione della corrente elettrica sui componenti delle soluzioni di composti salini, di acidi o di basi forti, condusse M. Faraday alla formulazione di leggi quantitative che sono alla base dei fenomeni elettrochimici dell’elettrolisi. Per i nostri scopi ci basta sapere che tali esperimenti rivelano la presenza di cariche elettriche nella materia. Poiché essa è formata in ultima analisi da atomi, tali esperimenti confermano la presenza, in alcuni composti, di atomi carichi positivamente e di atomi carichi negativamente. Tali atomi vengono chiamati ioni e i composti nei quali sono già presenti ioni di carica opposta sono chiamati elettroliti. Gli ioni positivi sono chiamati cationi, quelli negativi anioni.
Figura 1
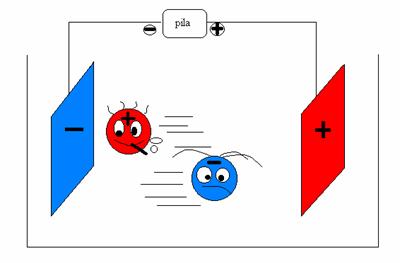
Come esempio, consideriamo una soluzione acquosa di cloruro di sodio, NaCl, nella quale vengono immersi due elettrodi collegati ad una pila. Il passaggio della corrente elettrica nel circuito è assicurato dalla presenza, nella soluzione, dei cationi sodio e degli anioni cloro che migrano rispettivamente verso il polo negativo, o catodo, e verso quello positivo, o anodo. (figura 1)
Sebbene gli esperimenti elettrochimici abbiano messo in evidenza l’esistenza delle cariche elettriche negli atomi, essi tuttavia non possono rispondere a due domande cruciali: 1) come sono organizzate le cariche elettriche presenti negli atomi?; 2) in quale modo esse concorrono alla formazione delle molecole? Gli studi cominciati dalla seconda metà dell’ottocento hanno fornito le risposte.
LA SCOPERTA DELL ’ELETTRONE
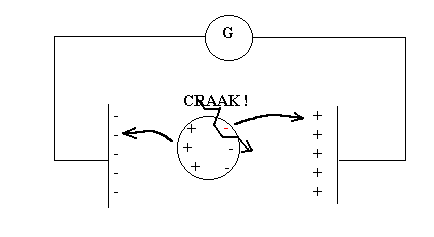
Mentre l’elettrolisi delle soluzioni elettrolitiche può essere condotta imponendo differenze di potenziale di pochi volt tra gli elettrodi, la scarica elettrica nei gas si verifica con differenze di potenziale molto più alte. La differenza, in questi due fenomeni di conduzione elettrica, consiste nel fatto che, mentre nelle soluzioni elettrolitiche gli ioni sono già presenti nella sostanza che viene dissolta in acqua, nei gas le molecole o gli atomi sono allo stato elettricamente neutro. Se, come è vero, all’interno degli atomi esistono delle cariche elettriche, esse devono annullarsi reciprocamente e sono soggette a forze di attrazione reciproca. Ionizzare un atomo o una molecola neutra richiede pertanto una notevole energia. Essa viene appunto fornita dal campo elettrico intenso che si stabilisce fra i due elettrodi entro i quali si trovano le particelle del gas. Quando le forze elettriche del campo esterno vincono le forze di attrazione interne delle cariche elettriche dell’atomo avviene la ionizzazione, con la formazione della scarica elettrica e contemporanea produzione di luce e calore.(figure 2 e 3)
Figura 2
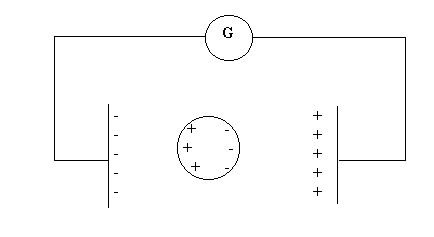
Figura 3
Un sostanziale progresso nello studio delle scariche nei gas fu fatto quando Crookes scoprì la tecnica per saldare tenacemente il vetro al metallo. In tal modo fu possibile confinare il gas e gli elettrodi in un involucro di vetro a tenuta e studiare le caratteristiche delle scariche elettriche a pressioni notevolmente inferiori a quella atmosferica mediante l’uso di pompe aspiranti.
Si osserva che al diminuire della pressione all’interno dell’ampolla di vetro, le scariche elettriche assumono percorsi meno tortuosi e sono meno luminose. Quando la pressione scende a valori intorno a 1mmHg si verificano fenomeni di luminescenza diffusa nello spazio situato tra i due elettrodi (ciò che succede nel normale funzionamento di un “tubo a neon”).
Se la conduzione elettrica in questi esperimenti è assicurata dalla presenza di atomi o molecole di un gas ionizzati dall’elevata differenza di potenziale elettrico che si stabilisce fra gli elettrodi, un vuoto molto spinto dovrebbe causare la cessazione dei fenomeni descritti, poiché sarebbero troppo poche le particelle ionizzabili in grado di trasportare corrente elettrica.
Contro tutte le previsioni, abbassando la pressione al valore di circa 10-5 atmosfere e applicando una differenza di potenziale di alcune migliaia di volt, si osservò che il circuito nel quale era inserita l’ampolla era sempre percorso da corrente elettrica e che all’interno dell’ampolla era possibile notare la presenza di una radiazione debolmente luminosa che permeava lo spazio tra i due elettrodi.
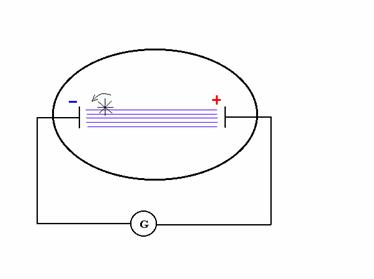
Per chiarire la natura di tale radiazione, se cioè essa fosse costituita da particelle o da onde elettromagnetiche, furono posti degli ostacoli sul percorso della radiazione. Introducendo, ad esempio, una leggerissima girandola costituita da pale sottilissime di alluminio si osservò che essa ruotava. Ciò indicava che la radiazione è di natura particellare. Infatti, solo particelle materiali, urtando contro le pale, possono comunicare quantità di moto e mettere in rotazione la girandola.(figura4)
Figura 4
Inoltre il senso di rotazione della girandola indicava chiaramente che le particelle costituenti la radiazione provengono dal catodo (polo negativo). Per questo la radiazione fu designata col termine “raggi catodici”.
Per determinare l’eventuale natura elettrica di tali particelle, si utilizzarono anodi forati, in modo da analizzare il fascio di particelle al di fuori della zona di accelerazione (figura 5). In tal modo il fascio attraversava una zona nella quale erano posti due elettrodi in modo da creare un campo elettrico trasversale alla direzione di moto del fascio stesso. Si osservò che il fascio deviava verso la placca anodica (positiva), indicando che le particelle, oltre che una massa, possedevano anche una carica elettrica negativa. La posizione del fascio poteva essere individuata introducendo nella parte interna dell’involucro di vetro un sottile strato di materiale sensibile alle radiazioni (che emette luce quando viene colpito da queste).
Figura 5
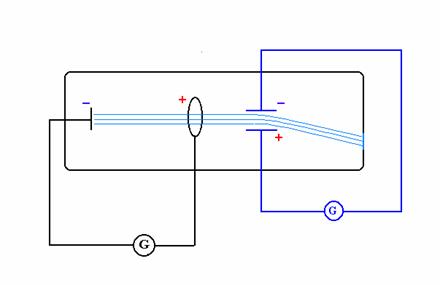
Thomson riuscì a determinare il rapporto massa/carica di queste particelle, utilizzando l’azione concomitante di un campo elettrico e di uno magnetico, agenti in una stessa zona e disposti in modo che le loro linee di forza fossero perpendicolari tra loro e alla direzione di moto delle particelle stesse. Agendo sull’intensità dei due campi in modo da evitare la deflessione delle particelle, poté misurarne per via indiretta la velocità e quindi il rapporto m/c (vedi figura 6)
Figura 6

Le numerose esperienze effettuate portarono alle seguenti conclusioni:
1) il rapporto m/c non dipende dalla natura del gas residuo nel tubo catodico;
2) il rapporto m/c non dipende dalla natura dell’elemento che funge da catodo;
Le particelle negative sono emesse dal catodo e poiché questo, in ultima analisi, è costituito da atomi, ne deriva che sono questi ultimi i responsabili dell’emissione delle particelle. Il fatto che il rapporto m/c non dipenda dalla particolare natura del catodo, indica chiaramente che tali particelle sono contenute negli atomi di qualunque elemento chimico e perciò sono i portatori elementari universali della carica negativa. A tali particelle fu dato il nome di elettroni. Misure recenti del rapporto m/c dell’elettrone danno il valore di 5,686×10-12 Cuolomb/kg.
LA SCOPERTA DEL PROTONE
Fra i fenomeni osservabili nei tubi catodici, i raggi catodici non sono i soli che si siano rivelati di fondamentale importanza nel chiarire la natura elettrica dell’atomo. Servendosi di un catodo perforato Goldsein scoprì che prendevano corpo anche raggi di un’altra specie. Tali raggi si muovevano in direzione opposta a quella dei raggi catodici, il che autorizzava ad ammettere che essi erano costituiti da particelle cariche positivamente. Adoperando gas di natura diversa si trovò che, a differenza dei raggi catodici, questi raggi positivi manifestavano rapporti m/c dipendenti dalla natura del gas residuo nel tubo catodico, ma erano indipendenti dalla natura dell’elemento che fungeva da anodo. Oggi sappiamo che i raggi positivi si formano in seguito alla ionizzazione delle molecole di gas ad opera del fascio di elettroni emesso dal catodo.
Sfruttando metodi analoghi a quelli impiegati per determinare il rapporto m/c dell’elettrone, si dimostrò che il minimo valore di questo rapporto nei raggi positivi si otteneva quando il gas residuo nel tubo catodico era costituito da idrogeno. La particella positiva formata in queste circostanze possedeva un rapporto m/c 1836 volte maggiore di quello dell’elettrone. Inoltre i rapporti m/c, misurati quando di volta in volta rimanevano in forma residua nel tubo catodico gli altri elementi gassosi, erano tutti multipli del rapporto m/c misurato per l’idrogeno. Ciò significa che la particella di carica positiva che rimane dopo la ionizzazione dell’atomo di idrogeno deve entrare un numero intero di volte nella costituzione degli atomi dei vari elementi chimici. Pertanto essa è un costituente fondamentale dell’atomo, nonché il portatore elementare della carica positiva. A tale particella fondamentale fu dato il nome di protone.
Il numero di protoni, o di elettroni, è ciò che caratterizza in maniera determinante le proprietà chimiche e fisiche di un elemento chimico. Tale numero viene chiamato numero atomico (N.A.) di un elemento.