LA CONDUCIBILITA’ ELETTRICA DELLE SOLUZIONI
Per conducibilità di una soluzione si intende l’inverso della sua resistenza elettrica:
![]() (1)
(1)
Le sue unità di misura sono: [ohm-1 = mho = siemens(S)]
In base alla seconda legge di Ohm la resistenza è legata alle caratteristiche geometriche del conduttore attraverso la relazione:
![]() (2)
(2)
dove r è la resistività o resistenza specifica [ohm×cm]. Inserendo la (2) nella (1) si ottiene:
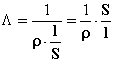
L’inverso della resistività , cioè 1/r, viene chiamato conduttività o conducibilità specifica, indicata con la lettera c. Quindi:
![]()
La misura della conducibilità di una soluzione viene realizzata mediante un dispositivo denominato conduttimetro a cui sono collegati due elettrodi. Questi ultimi, immersi nella soluzione da analizzare, costituiscono la cella conduttimetrica.
Gli elettrodi , solitamente di platino platinato, possiedono una superficie S e sono disposti ad una certa distanza l fra loro
Il rapporto S/l caratterizza l’intera geometria della cella e dipende anche dalle caratteristiche fisiche degli elettrodi. Per questo motivo tale rapporto viene solitamente indicato con K [cm], denominato costante di cella.
La legge fondamentale su cui si basa la conduttimetria assume dunque la forma:
![]()
Le soluzioni elettrolitiche conducono l’elettricità in misura molto inferiore ai metalli, ma molto più dei solventi organici che non dispongono di ioni mobili.
Esaminiamo ora qualitativamente i fattori che agiscono sul meccanismo della conduzione e che perciò influiscono sul valore di c.
Tali fattori sono:
a.
Le concentrazioni ioniche
La capacità di trasportare la corrente da parte di una soluzione dipende dal numero di specie ioniche in essa presenti, e dunque dalla sua concentrazione. Questo fattore è comunque strettamente legato al grado di dissociazione, specialmente per gli elettroliti deboli.
b.
Le cariche ioniche
Uno ione bivalente trasporta ovviamente, fatte salve le altre condizioni, una quantità di elettricità doppia di uno ione monovalente.
c. Le velocità di migrazione
degli ioni
Esse sono legate al rapporto carica/raggio, alla massa, alle varie forze d’interazione ione-ione e ione-solvente, nonché alla viscosità di quest’ultimo.
CONDUCIBILITA’ EQUIVALENTE E LEGGE DI KOHLRAUSCH
Per quanto la conducibilità
specifica c
sia un parametro di fondamentale importanza in conduttimetria, la sua dipendenza
dalla carica degli ioni la rende tuttavia inadatta ai confronti tra elettroliti
diversi. Perciò è stata elaborata una definizione della conducibilità che fa
riferimento ad una mole di cariche elettriche,
cioè ad un equivalente di elettrolita. Questo nuovo parametro viene chiamato conducibilità
equivalente (Le) e definito come la conducibilità di una soluzione in cui si trova disciolto
un equivalente di elettrolita, situata fra due elettrodi distanti fra loro un
centimetro.
Possiamo esprimere la conducibilità equivalente nel seguente modo:
![]()
infatti c rappresenta la
conducibilità di una soluzione avente il volume di 1 cm3 (elettrodi
di 1 cm2, distanti 1 cm) e moltiplicando questa per il volume
nel quale è contenuto 1 equivalente di elettrolita, Ve, espresso in cm3
(o ml), otteniamo la conducibilità di una soluzione
nella quale è presente un equivalente di elettrolita, Le.
Inoltre,
poiché la normalità di una soluzione è definita da:
![]() ,
,
il volume nel quale è sciolto 1
equivalente di elettrolito è:
![]() .
.
Quindi:
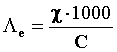 [S×cm2/eq]
[S×cm2/eq]
L’andamento della conducibilità equivalente con la concentrazione per alcuni elettroliti è riportato nella seguente figura:

L’Esame delle curve fornisce informazioni interessanti. Innanzitutto si può notare l’evidente differenza di comportamento
Fra gli elettroliti forti e
quelli deboli (l’acido acetico). I primi infatti presentano valori di Le quasi costanti in un ampio intervallo di concentrazione e
nettamente superiori a quelli degli elettroliti deboli. Questi dati si spiegano
considerando che gli elettroliti forti sono praticamente dissociati al 100% in
soluzione anche a concentrazioni non molto basse, mentre gli elettroliti deboli
sono poco dissociati in ioni, e tanto meno quanto più concentrata è la
soluzione. La diluizione delle soluzioni provoca un aumento della conducibilità
delle soluzioni di elettroliti forti a causa della diminuzione dell’interazione
tra gli ioni, ed un aumento ancora più marcato per gli elettroliti deboli, a
causa dello spostamento dell’equilibrio di dissociazione verso la formazione
degli ioni. In tutti i casi, dunque, la Le tende ad un valore limite, a cui si dà il nome di conducibilità
equivalente a diluizione infinita, Lo[S×cm2/eq].
Questo
nuovo parametro è di grande utilità nel confronto tra elettroliti diversi
perché risulta indipendente non solo dalla carica, ma anche dalle interazioni
interioniche in quanto si riferisce a diluizioni infinite.
Dall’esame
dei valori di tale parametro per diversi elettroliti, Kohlrausch formulò la legge della migrazione indipendente
degli ioni, in base alla quale la conducibilità equivalente a diluizione infinita di un
qualunque elettrolita è data dalla somma fra le conducibilità equivalenti
limite dei
singoli ioni:
![]()
Infine, per gli elettroliti forti esiste un’interessante relazione fra Le e la radice quadrata della concentrazione espressa in equivalenti/litro (ÖC), scoperta empiricamente da Kohlrausch e poi elaborata teoricamente da Onsager:
![]()
detta spesso equazione di Onsager.