Torna a ARGOMENTI DI CHIMICA ORGANICA
AMMINOACIDI
Gli
aminoacidi più comuni che costituiscono le proteine sono tutti a-amminoacidi
corrispondenti alla formula generale:
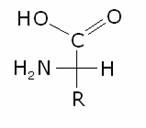
In
quasi tutti gli a-amminoacidi naturali la configurazione dell’atomo di
carbonio a, asimmetrico, è L (ponendo il gruppo carbossilico in
alto), cioè è legato al gruppo amminico alla sua sinistra. Fa eccezione la
glicina, che è l’unico amminoacido achirale:
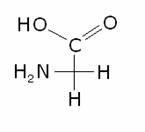
Gli
a-amminoacidi possono essere classificati in 4 gruppi
in base alla natura del gruppo R:
1)
amminoacidi con gruppi R non polari;
2)
amminoacidi con gruppi R polari neutri;
3)
amminoacidi con gruppi R basici;
4)
amminoacidi con gruppi R acidi.
1)
Amminoacidi con gruppi R non polari
Fanno
parte del primo gruppo la glicina, l’alanina,
la fenialanina, la valina, la leucina, l’isoleucina,
la prolina, il triptofano e la metionina.
Es.:
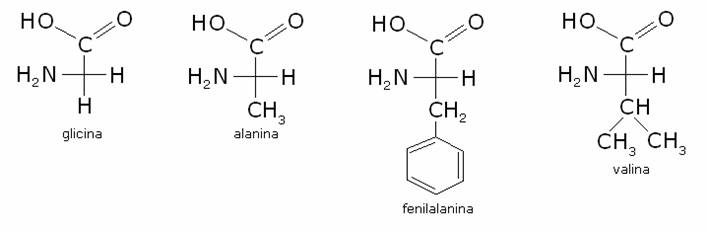
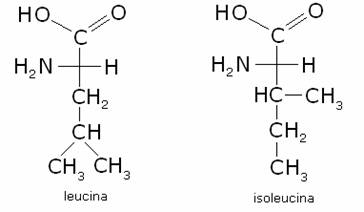
2)
Amminoacidi con gruppi R polari neutri
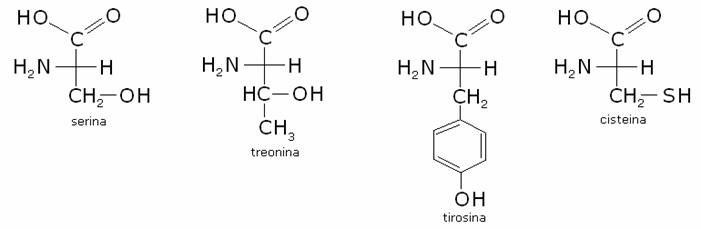
Fanno
parte di questo gruppo la serina, la
treonina, la tirosina, la cisteina, l’asparagina e la glutammica. Es.:
3)
Amminoacidi con gruppi R basici
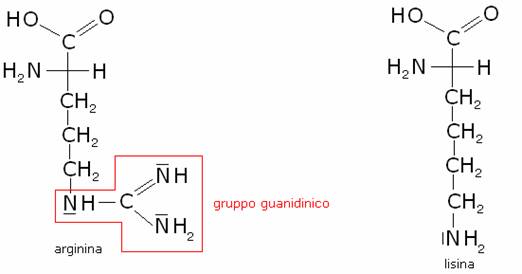
Fanno
parte di questo gruppo l’arginina,
la lisina e l’istidina. Es:
Di
questi il più basico è l’arginina, a causa della stabilizzazione della carica
positiva operata dal gruppo guanidinico, una volta che sia protonato:
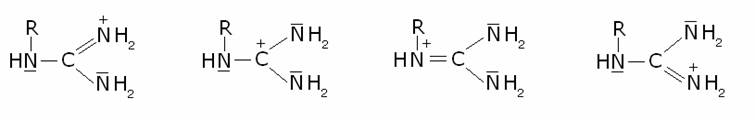
4)
Amminoacidi con gruppi R acidi
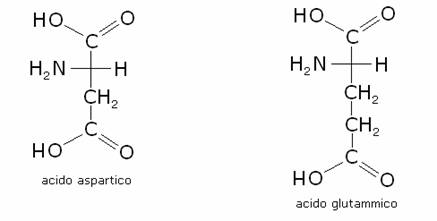
Fanno
parte di questo gruppo due amminoacidi, l’acido aspartico e l’acido glutammico:
PROPRIETA’ ACIDE E BASICHE DEGLI AMMINOACIDI
Gli
amminoacidi sono solidi cristallini solubili in acqua, con punti di fusione
elevati, nonostante il peso molecolare molto grande. Tutte queste proprietà
sono dovute al fatto che gli amminoacidi esistono prevalentemente nella forma dipolare o zwitterionica:
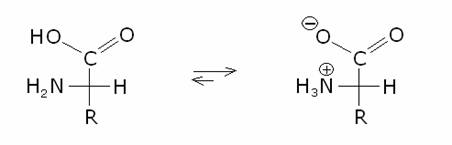
Gli
amminoacidi hanno comportamento anfotero,
poiché possono reagire sia come acidi, donando un protone, sia come basi,
accettando un protone:
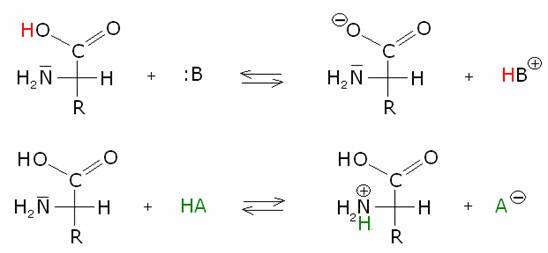
In
ambiente nettamente acido gli amminoacidi esistono quindi in forma protonata
come acido biprotico, in grado di donare due protoni a due equivalenti di base
(vedi reazione sottostante). In una titolazione con una base, a partire da un
ambiente acido, perciò, avvengono in sequenza i due trasferimenti di protoni:
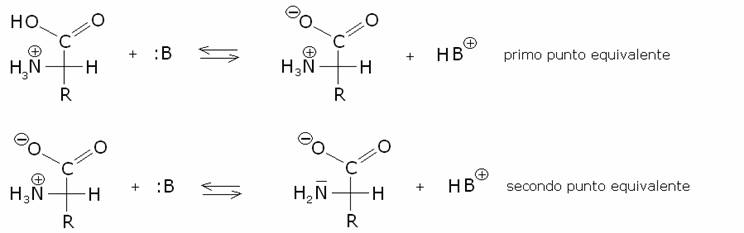
L’aggiunta
del primo equivalente di base B serve a neutralizzare il gruppo carbossilico
(Ka ≈5∙10-5). Si arriva così al primo punto equivalente
della titolazione. Il secondo equivalente di base serve a neutralizzare il
gruppo ammonio (Ka ≈2∙10-10). Si arriva così al secondo
punto equivalente della titolazione.
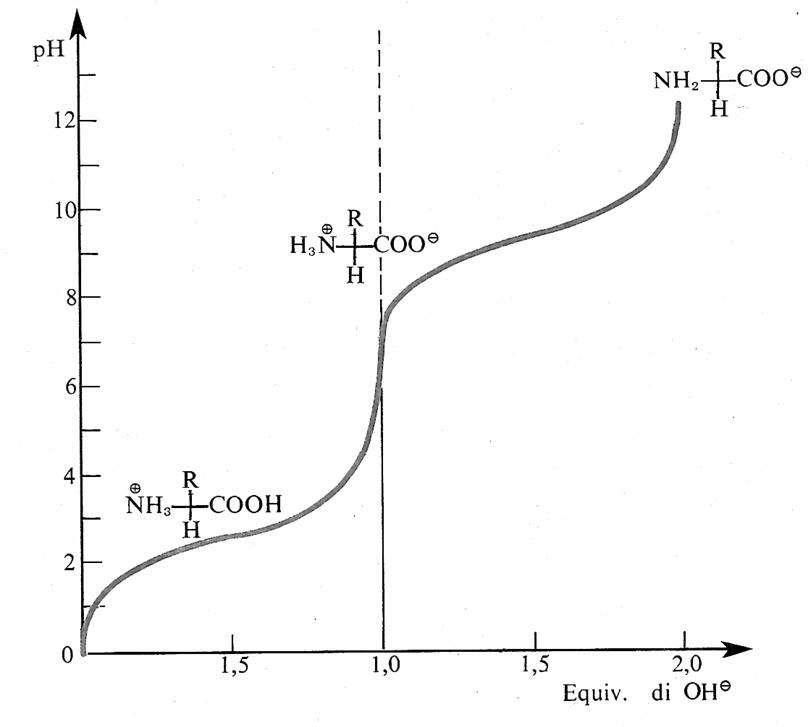
Come si vede dalla curva di
titolazione, in ambiente acido (a pH = 0) l’amminoacido si trova forma di ione
positivo e se viene posto in un campo elettrico esso migra verso il catodo
(polo negativo). D’altra parte, in ambiente basico l’amminoacido si trova sotto
forma di ione negativo, che migra verso l’anodo. Ad un dato valore del pH la molecola ha carica totale zero, per cui
essa non si muove se viene posta in un
campo elettrico; tale valore di pH viene chiamato punto isoelettrico.
Gli
amminoacidi neutri (amminoacidi apolari e amminoacidi polari neutri) hanno
punti isoelettrici leggermente inferiori a 7. Gli amminoacidi basici hanno
punti isoelettrici maggiori di 7: essi infatti per esistere come molecola con
carica elettrica 0 hanno bisogno di un eccesso di base per neutralizzare la
forma protonata del secondo gruppo basico. Analogamente gli amminoacidi acidi
hanno punti isoelettrici inferiori a 7 perché essi sono a carica 0 solo in
presenza di acidi, che impediscono la dissociazione del secondo gruppo
carbossilico.
DOSAGGIO DEGLI AMMINOACIDI
a) Metodo di
Van Slyke.
Gli amminoacidi, come tutte le ammine
primarie, reagiscono con acido nitroso, liberando una molecola di azoto per
ogni gruppo amminico. L’azoto può venire raccolto e dalla sua quantità,
determinata volumetricamente, si può risalire al numero di gruppi amminici
presenti.
b) Reazione con
la ninidrina.
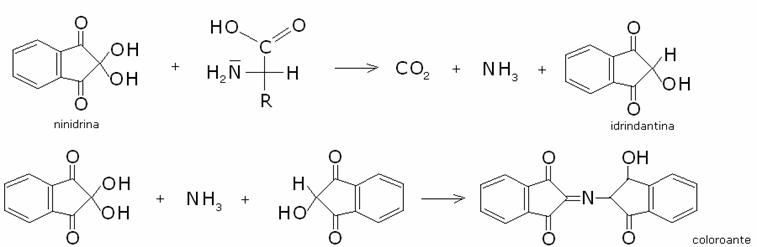
PEPTIDI
Sono poliammidi le cui unità monomeriche sono
costituiti da a-amminoacidi. I peptidi possono essere formati da due
amminoacidi (dipeptidi), tre
amminoacidi (tripeptidi), e così
via. I peptici formati da un numero limitato di amminoacidi sono chiamati oligopeptidi, mentre sono chiamati polipeptidi quelli con peso molecolare
elevato: le proteine sono
polipeptidi con peso molecolare molto elevato, superiore a 10.000. Le strutture
dei peptici vengono solitamente rappresentate scrivendo in successione le sigle
degli amminoacidi, cominciando da quello in cui il gruppo amminico è libero,
detto amminoacido N-terminale, e
terminando con quello in cui è libero il gruppo carbossilico, amminoacido C-terminale.
La
struttura delle proteine.
La conoscenza della struttura di una proteina si
articola in tre, e talvolta quattro, livelli:
1) La struttura
primaria: è data dalla sequenza degli
amminoacidi che costituiscono la catena polipeptidica.
2) La struttura
secondaria: è la disposizione
regolare, spesso a spirale o a zig-zag, di una catena polipeptidica nello
spazio soprattutto lungo una dimensione.
3) La struttura
terziaria: è la disposizione
tridimensionale che la spirale assume
nello spazio ripiegandosi e avvolgendosi.
4) La struttura
quaternaria: è la disposizione
reciproca delle varie catene polipeptidiche nelle proteine costituite da due o
più unità polipeptidiche.
La determinazione della struttura primaria dei peptidici
La
determinazione della sequenza degli amminoacidi di una catena polipeptidica
richiede una serie complessa di operazioni:
-
il polipeptide viene purificato in modo che abbia una
composizione chimica unitaria;
-
Viene determinato il peso molecolare del
polipeptide;
-
Un campione del
polipeptide viene sottoposto a idrolisi totale e la miscela di amminoacidi così
ottenuta viene analizzata in modo da determinare la composizione in amminoacidi;
-
Per determinare
la sequenza degli amminoacidi della catena polipeptidica, si comincia col determinare quale è il primo amminoacido
della catena, o amminoacido N-terminale, e quale è l’ultimo amminoacido, o
amminoacido C-terminale.
-
La catena
polipeptidica viene scissa per blanda
idrolisi chimica o enzimatica in frammenti oligopeptidici contenenti da due a
cinque unità amminoacidiche. Questa scissione viene ripetuta con metodi
diversi in modo che le rotture avvengano in punti della catena diversi dai
precedenti.
-
Si confrontano le
diverse serie dei frammenti ottenuti per idrolisi: combinando i frammenti con unità comuni, si ottiene l’intera sequenza.
1) Determinazione
dell’amminoacido N-terminale.
L’amminoacido
N-terminale viene identificato sfruttando il fatto che il gruppo amminico è
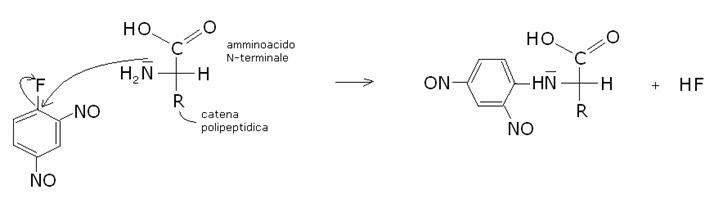
libero e non impegnato in legami ammidici. Uno dei metodi usati è il metodo di Ranger, basato sull’uso del
reagente 2,4-dinitrofluorobenzene.
Trattando un peptide con questo reagente si ha una reazione di sostituzione elettrofila aromatica in cui il gruppo
amminico libero sostituisce il fluoro, con formazione di un
2,4-dinitrofenilamminoacido che può essere separato dagli altri amminoacidi ed
identificato per confronto cromatografico con campioni noti di
2,4-dinitrofenilderivati degli amminoacidi.
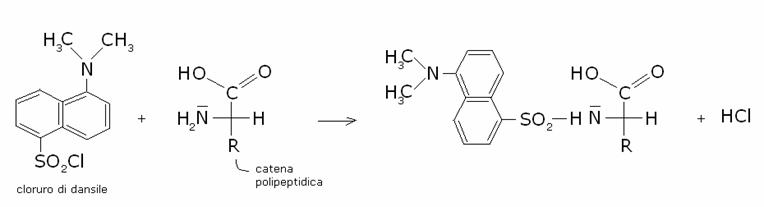
Un altro reagente comunemente usato è il cloruro di 1-dimetilamminonaftalen-5-solfonile o dansile:
2)
Determinazione dell’amminoacido C-terminale.
Con metodi
chimici si può effettuare con
-
l’idruro di litio
e boro (LiBH4). Viene ridotto solo il gruppo carbossilico terminale
ad alcole primario, mentre i gruppi ammidici rimangono inalterati. Per
successiva idrolisi del peptide si ottiene un amminoalcole corrispondente al
residuo C-terminale, mentre tutte le altre unità vengono ottenute come
amminoacidi liberi.
-
il trattamento
del peptide con idrazina (idrazinolisi)
tutti i legami peptidici trasformando tutti gli amminoacidi in idracidi, tranne
l’amminoacido C-terminale.
-
L’uso dell’enzima
carbossipeptidasi, che rimuove
selettivamente l’amminoacido C-terminale.
Torna a ARGOMENTI DI CHIMICA ORGANICA
APPROFONDIMENTO:
CALCOLO DEL pH AL PUNTO
ISOELETTRICO