"Acidi, Basi e Tamponi "
Per i sistemi biologici, uno dei parametri più importanti di una soluzione acquosa è la concentrazione dei protoni, [H+]. Benchè la sua concentrazione è solitamente bassa dell'ordine da 10-6 a 10-8 M, deve essere mantenut in questo campo di valori affinchè possa esserci la vita. Gli acidi deboli si dissociano in acqua secondo l'equilibrio
![]()
che viene riscritta come la seguente perchè la [H2O] può ritenersi costante
![]()
La Costante di detto equilibrio è Ka = [A-][H+]/[HA]. I valori di dette costanti per i sistemi biologici sono molto minori di 1 e vengono riportati come pKa=-logKa. Analogalmente si parla di pH per indicare -log[H+].
Curve di titolazione
La Glicina contiene due gruppi acidi deboli: il gruppo carbossilico con pKa pari a 2,4 e il gruppo amminico con pKa=9,8.La figura di seguito mostra anche lo stato di ionizzazione della glicina man mano che il pH della soluzione diventa simile a quello delle pKa.

Questa di seguito è la curva di titolazione per il
glicina. Le aree verdi sono le regioni tampone. In queste aree c’è
un piccolo relativo cambiamento di pH sebbene le percentuali di titolazione
cambino significativamente.
Il +, +/-, e - dimostrano le regioni di pH dove queste forme ioniche (vedi
sotto) predominano. Molti punti lungo la curva di titolazione possono
essere calcolati usando l’equazione di Henderson-Hasselbalch-pH=pKa+log
{[A-]/[HA]}.

Derivazione dell'equazione di Henderson Hasselbalch

Mantenere il pH del sangue stabile con un sistema tampone di bicarbonato.
Il buon senso afferma che il tampone mantiene costante il
pH quando il pH=pKa ±1. Ancora un maggior
tampone nel sangue è l’acido carbonico/bicarbonato, con un
sistema tampone che ha pKa=6.1, più di una unità in meno
del sangue a pH=7.4.
Questo vuol dire che Madre Natura non comprende i tamponi? Niente affatto.

Il sistema tampone acido carbonico/bicarbonato ha una proprietà unica per cui l’acido, H2CO3, è in equilibrio con il gas CO2.
A causa di ciò, la concentrazione di H2CO3 nel sangue è fissata dalle concentrazioni di CO2 nella fase gassosa la cui concentrazione è determinata a sua volta dalle concentrazioni di CO2 nei polmoni. La CO2 contenuta nei polmoni dipende dall’andamento della produzione di CO2 nel metabolismo e dall’andamento del respiro.
Il lento respiro (ipoventilazione) aumenta il contenuto di CO2 e il rapido respiro (iperventilazione) diminuisce il contenuto di CO2. Le concentrazioni di CO2 nei polmoni è riportata nelle parziali pressioni di CO2=pCO2.
Le pressioni parziali sono la strada di composizione di gas. Al livello del mare, la pressione atmosferica=760mm Hg. Se la CO2 comprende il 5.25% dei gas, il pCO2=40mm Hg -il valore normale nei polmoni.
Per questi sistemi, l’equazione di Henderson-Hasselbach,
![]()
dove 0.03 è la costanteche stabilisce la solubilità di CO2 nell’acqua. Perché questo sistema è così grande?
Se noi aggiungiamo l’acido nei sistemi questa reagisce con HCO3- e produce H2CO3 (HCO3- + H+-->H2CO3). Ma, l’eccesso di H2CO3 è convertito in CO2 che abbandona la soluzione. Così, [H2CO3] rimane costante.
Se noi aggiungiamo una base nel sistema questa reazione con H2CO3 produce HCO3- (H2CO3+OH--->HCO3-+H2O). Ma più CO2 si dissolverà nella soluzione. Così, [H2CO3] rimane costante.
L'effetto complessivo è che il denominatore dell’equazione di Henderson-Hasselbach rimane costante, con più bassa frequenza il pH cambierà solo leggermente se aggiungiamo H+ o OH-.
Inoltre si può aggiustare l’andamento del respiro che provoca cambiamenti di pCO2: lento respiro (ipoventilazione) causa un aumento di pCO2; un rapido respiro (iperventilazione) causa una diminuzione di pCO2. Questo intermedio di pH=7.4, può mantenere piana le facce di larghezza di acidi o basi.
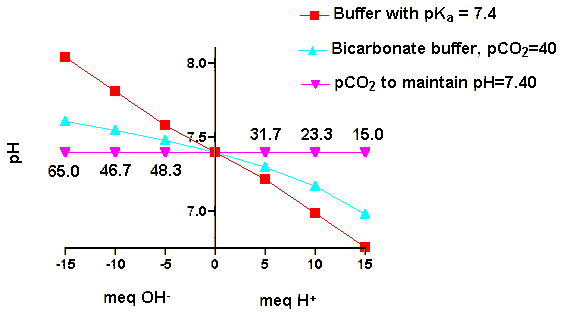
Questi effetti sono illustrati quantitativamente nella tabella qui sotto, con la dimostrazione di cambiamenti di pH in reazioni di addizione di H+ o OH- di differenti sistemi tampone. Tutti i sistemi tampone iniziano a pH=7.4.
A - Tampone a pKa = 7.4 contenente 24 meq each of HA and A-
B - Tampone bicarbonato senza CO2 in fase gas ; [H2CO3] = 1.2 mM and [HCO3-]=24 mM
C - Tampone bicarbonato with pCO2 = 40 mm in fase gas ; [H2CO3] = 1.2 mM e[HCO3-]=24 mM
D - Valore di pCO2 necessari a mantenere il pH a 7,4 in un tampone contenente [H2CO3] = 1.2 mM e [HCO3-]=24 mM
| Tampone |
5 meq H+ |
10 meq H+ |
15 meq H+ |
5 meq OH- |
10 meq OH- |
15 meq OH- |
| A |
pH=7.2 |
pH=7.0 |
pH=6.8 |
pH=7.6 |
pH=7.8 |
pH=8.0 |
| B |
pH=6.5 |
--- |
--- |
11.6 |
--- |
--- |
| C |
pH=7.3 |
pH=7.17 |
pH=7.0 |
pH=7.48 |
pH=7.55 |
pH=7.61 |
| D |
pCO2=31.7 |
pCO2=23.3 |
pCO2=15.0 |
pCO2=48.3 |
pCO2=56.7 |
pCO2=65.0 |