 |
Dall' Icosaedro al Fullerene C 60
Il carbonio allo stato elementare si manifesta come grafite o
come diamante, mentre allo stato combinato è l'elemento
fondamentale della chimica organica. Sia la grafite che il
diamante sono composti da carbonio puro, la loro differenza sta
nella struttura cristallina.
La grafite tipica si aggrega in masse lamellari con gli atomi
disposti ai vertici di un esagono; queste lamelle non sono
compatte e scivolano facilmente fra loro, ne è un esempio la
matita che, con una minima pressione, cede queste lamelle alla
carta. Il diamante ha un'aggregazione cristallina a forma di
ottaedro (terzo solido platonico) che è molto stabile. Questi
due aspetti del carbonio sono usati come riferimento per la
misura della durezza dei materiali (grafite durezza 1 e diamante
durezza 10). Ulteriori aggregazioni del carbonio (macromolecole)
sono state scoperte nelle regioni interstellari ma solo nel 1985
si è potuto riprodurle in laboratorio.
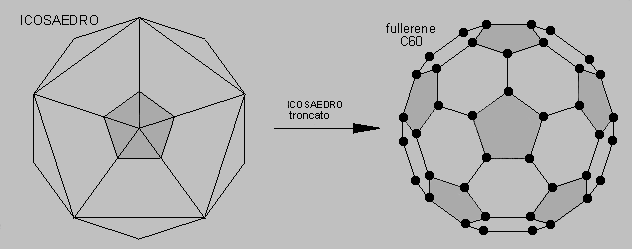
La macromolecola più comune prodotta in laboratorio è
composta da 60 atomi di carbonio ed è risultata la più stabile.
La posizione spaziale di questi 60 atomi è tale da riprodurre il
sesto solido semiregolare di Archimede (12 pentagoni e 20
esagoni). Rivediamo nella seguente figura il sesto
solido semiregolare:
 |
Le altre macromolecole finora ottenute in laboratorio sono: C70, C76, C78, C84, C240, C540 e C960. Disegnare la posizione degli atomi di carbonio che formano una macromolecola non è facile tranne che per il C60 perchè si parte dall'icosaedro.
Il nome "fullerene" è stato dato a queste
macromolecole in onore dell'architetto Buckminster Fuller che
progettò abitazioni a forma di cupola geodetica.
Una particolarità: il numero dei pentagoni in qualsiasi
fullerene è sempre di 12. Chi volesse approfondire l'argomento
può trovare su Internet abbondante materiale in merito.
| torna a: | 4 - I 13 solidi di Archimede | Indice |